摘要:许多人都想知道动物医学论文怎么写题目大全,如何选题最新还有参考文献大全,今天668论文网李老师就给大家精选出15篇动物医学论文范文2000字-3000字供大家参考,希望对您有所帮助!
相关推荐:动物医学论文题目(点击可查看)

动物医学论文范文 第1篇
题目:风险评估在动物疫病及动物产品上的应用
摘要:通过对近年来风险评估技术在动物疫病和动物产品上的应用情况的研究,从国内外两个方面进行阐述,综述了国外风险评估体系及应用现状和国内的应用进展,并针对我国目前风险评估体系建设情况提出了相应的建议。风险评估技术在动物及动物产品上的应用主要包括动物疾病的检测和预警以及动物产品的加工过程的监控。
关键词:沙门疫病动物
风险评估是系统地采用一切科学技术及信息,在特定条件下,对动物、植物和人类或环境暴露于某危害因素产生或将产生不良效应的可能性和严重性的科学评价。风险评估技术在国外动物疫病控制和食品安全方面得到了广泛系统的发展和应用。我国农业部在2002年成立了动物疫病风险评估小组,依据世界动物卫生组织(OIE)的有关规定对中国动物疫病进行了风险评估,在2009年6月正式实施的《中华人民共和国食品安全法》提出了加强食品风险评估体系建设。近年来,我国在动物疫病和食品安全方面初步建立了风险评估体系,尽管在某些方面取得了一定的成绩,但是在技术上和应用程度上都与发达国家存在很大差距。
1 发达国家建立了重大动物疫病控制系统
在动物医学领域中,口蹄疫、蓝舌病、非洲猪瘟、牛海绵状脑病、高致病性禽流感等传染病的监测中都有风险评估方面的研究。许多发达国家都建立了重大动物疫病控制系统,不仅为风险评估提供大量真实的数据,而且可以通过与地理信息系统(Geographic information system,GIS)技术的结合,对疫病的发生进行预警,从而判断和控制动物和人群中疾病的发生,大大降低了由动物疫病带来的各方面损失 [1]。如荷兰通过对574个家禽饲养场进行禽流感的风险因素调查发现,禽流感的传播与禽舍的类型和周围是否饲养其他动物的关系不大,而饲养场之间的蛋托和蛋箱的使用会增加禽流感传播风险 [2]。Andraud M和RoseN等 [3-5]在2010建立了猪圆环病毒病在猪场中传播的风险分析模型,该模型是个体动物为基础产生随机模型与猪圆环病毒2型(Porcine circovirus type 2,PCV-2)的流行病学动力学模型的结合,所涉及的主要参数来自于2008年发表的感染试验的论文,该论文是对猪圆环病毒在窝内及窝与窝之间进行传播的各种相关参数定量确定 [6]。而在2009年,Rose N等 [7]用以连续清楚的过程展现了风险分析在规模化猪场上的引用。首先采用猪场实地调研确定了猪断奶后多系统衰弱综合征(Post-weaning multisystemic wasting syndrome,PMWS)在猪场传播的风险因素,确定了在猪场管理中疫苗免疫的重要性,将它作为重要因素放入个体动物的动态随机模型中。再通过对风险因素的确定,各种试验确定相应的模型参数,制定最后的数学模型。Katharina D C等 [8]在2002年做的一个假设,猪由于饲喂进口受污染的饲料使猪发生感染的定量风险评估,该评估构建了猪暴露于受污染饲料的概念模型图。
新西兰农林部动物生物安全机构的有关专家,对口蹄疫传入新西兰进行了风险评估。新西兰主要动物疫病控制系统是EpiMAN,系统最初开始实施于口蹄疫(Foot-and-mouth disease,FMD),疾病由空间数据、文本数据和流行病学的知识组成数据库,将疾病和相关因子的流行病学与可确定因子将在哪些地方发生的GIS技术结合起来,从而描述在环境因素影响下的疾病空间分布。美国动物卫生和流行病学中心负责将通过监测等途径获得各种紧急动物疫情信息,并通过风险评估、流行病学分析、地理空间分析等多种手段对某种重大疫病可能对美国畜牧业造成的影响以及可能发生程度进行预警性风险分析,提出最佳应急方案。英国国际动物卫生处下设的国际动物疫情监测组,24h内形成《国外动物疫情定性风险分析》报告在英国农业部网站发布。欧盟的预警体系包括畜禽及其产品交易监测网络、实验室监测网络等多个监测网络。该体系中包括了重大动物疫病通报系统(Animal disease notification system,ADNS)、人畜共患病通报网络等疫情报告系统。欧、美等国家对采取疫苗注射预防口蹄疫的国家和地区进行免疫畜群抗体水平的长期监测,尤其是对受威胁地区的抗体监测。从而确定免疫时间和免疫程序,并通过对自然感染动物抗体监测来进行发病危害性评估 [9]。
2 我国初步构建了生猪疫病的风险评估基本框架
在我国动物卫生检疫工作中,风险分析也逐渐成为预防控制传染病的一种重要科学依据。通过风险评估,确定危害等级或危害程度,提出进行风险管理的具体措施,以达到控制传染病传入的目的。重大动物疫病状况评估,是基于风险评估理念,着眼于动物及动物源性产品的饲养、生产、运输消费的监管、检疫以及动物疫病控制等环节,以重大动物疫病状况为因变量,设定特定区域和特定时期内的动物疫病状况影响因素为变量,从而对相应时期和相应区域的重大动物疫病状况水平进行的宏观评判 [10]。
总结近些年来国内外对动物疫情风险分析的研究文献,目前我国动物疫病的定量风险评估主要是利用蒙特卡洛模型对疾病分布进行拟合,得出相应参数和分布类型。其中比较具有代表性的是李亮等 [11]利用蒙特卡洛法进行了风险评估的定量研究,以安徽省生猪为例,针对猪瘟、猪丹毒、猪肺疫等3种主要生猪疫病的风险分布进行拟合,利用蒙特卡洛模拟法得出了各自的风险分布类型及参数,证明Lognormal分布为3种疫病风险的最优分布。闫丽君等 [12]通过将疫病风险与生猪死亡数之间的关系进行量化,利用蒙特卡洛模型模拟来解决样本不足的问题。运用极值POT模型对我国生猪疫病灾害损失尾部分布进行r有效拟合,构建了生猪重大疫病损失的广义Pareto分布模型。利用风险价值法,实证分析和度量了我国生猪疫病发生的风险水平,计算出我国不同等级的生猪疫病风险损失的95%置信区间,并提出减轻和控制我国生猪重大疫病风险的政策建议。现代极值法与蒙特卡洛拟合法相比,避免了在分析极端事件的不足以及可以实现疫病风险的数字化。白金等 [13]根据现场调查、专家评议、风险矩阵分析等方法,确定了规模猪场猪瘟发病的各项风险因素;采用两两比较和层次分析法,分别计算出各项风险因子的组合权重系数,初步建立了风险评估模型。在对于其他动物方面,孙向东等 [14]探究影响奶牛布鲁菌病风险评估的主要因素及其影响顺序。从饲养与调入、繁育、饲养环境、混养情况四个方面,设定了评价指标体系,选取3个有代表性的地区进行了调查,应用系统多层次灰色关联熵分析方法进行奶牛布鲁菌病风险评估。
3 国际组织和发达国家建立了完善的动物产品风险评估体系
由于大多数发达国家根据国际组织的相关文献分析、细化风险分析的各种因素,通过建立风险评估将动物疫病控制得较好 [15],但来自畜产品加工等过程中污染的微生物对人类健康带来的风险远远高于动物疫病本身。国际组织和很多发达国家建立了对人类健康影响较大的致病菌风险评估体系,并发表了风险评估报告。目前联合国粮食及农业组织(Food and Agriculture Organization,FAO)与世界贸易组织(World Trade Organization,WTO)建立了几种微生物比较完善的微生物风险评估报告,其已经出版六个报告系列丛书:《沙门菌在鸡蛋和肉鸡中的风险评估一》,《沙门菌在鸡蛋和肉鸡中的风险评估二》,《病原体在食物和水中危害特征描述的指导原则》,《即食食品中单核细胞增生李斯特单胞增生菌风险评估的说明概要》,《即食食品中单核细胞增生李斯特单胞增生菌风险评估技术报告》,《强化婴儿食品中阪崎肠杆菌危害评估会议报告》。除此之外,FAO与WHO还进行了肉鸡中溶血性弧菌及海产品中霍乱弧菌的风险评估等其他微生物评估。不仅如此,国外对多种致病菌进行了风险评估的研究。例如,对大肠埃希菌O157的风险评估研究,Perez-Rodriguez F等 [16]建立了大肠埃希菌(O157:H7)在生鲜莴苣叶上的生长模型,模拟在商业工业的加工中的生长模型得到不同温度下最大生长率。Buchanan R L等 [17]研究了pH、NaCl浓度、温度和氧气对大肠埃希菌O157:H7的生长的影响,并根据得到的数据进行Gompertz方程拟合,修改了Gompertz方程的B和M参数,建立了一个基于Gompertz方程B和M参数自然对数变换的二次模型,从而建立了大肠埃希菌O157快速增长估计模型 [18]。Cassin M H等 [19]将定量风险评估(quantitative risk assessment,QRA)、情景分析和预测微生物学结合起来对大肠埃希菌O157:H7进行了定量评估,通过控制不同的pH、水分活度及氯化钠浓度来测定该菌的生长情况,对牛肉汉堡中的大肠埃希菌O157:H7建立了过程风险模型(process risk model,PRM)。该模型对病原体在食品生产过程中的加工、处理、消费进行了估计,并作为食品消费与健康的暴露评估。用蒙特卡洛模拟风险预测模型中的不确定性与变化性,通过对模型中预测因子的修改,可以显著降低感染大肠埃希菌0157:H7。其他微生物方面,Greinwea M等 [20]将贝叶斯域来补充蒙特卡洛模型不能处理模型参数的反馈的缺陷,用来构建完整的定量风险评估模型。西班牙学者是将统计学和二阶蒙特卡洛模型研究老人人群食用熟肉食感染李斯特菌的情况 [21]。Belda-Galbi C M等 [22]和Coulliette A D等 [23]研究不同的因素来降低对大肠埃希菌、李斯特菌和沙门菌等的感染风险。
4 风险评估技术在我国动物产品安全中得到初步推广和应用
我国的动物卫生风险分析起始于20世纪90年代中期,发展于21世纪,先后开展了大量动物卫生风险分析理论研究与应用,一些省份也建立起了动物卫生风险评估的组织和制度体系。为了加强食品安全风险评估在我国食品安全监管中的应用,我国颁布的《食品安全法》中规定,成立食品安全风险评估专家委员会开展食品安全风险评估工作,并将结果作为制定或修订食品安全标准和对食品安全实施监督管理的科学依据。
目前,我国已启动了食物中毒菌中的沙门菌和大肠埃希菌O157:H7的定量风险评估,旨在通过食物中毒暴发的调查和运用数学模型,估计引起食源性疾病的最低活菌摄入量或造成50%食用者发病的活菌量。在沙门菌方面,我国已经开展了大量工作,赵志晶等 [24]进行了中国带壳鸡蛋中沙门菌定量危险性评估的初步研究,该评估模型模拟了从农场到餐桌(即从生产到消费)由于消费带壳鲜鸡蛋引起沙门茵病的危险性,文中使用了大量的假设并且数据也十分有限,仅是为以后评估提供了一个框架,需要新的资料来不断完善其模型。王欢等 [25]通过@Risk软件推测合肥市地区市售鸡肉沙门菌的流行率进行鸡肉中沙门菌的食品安全风险评估,但没有对暴露评估中可能发生的人体摄入量进行评估。赵瑞兰等 [26]通过对沙门菌在不同条件下生长情况的研究,建立了不同温度下营养肉汤、鸡肉中沙门菌的生长模型,以及不同条件下沙门菌的失活/存活模型,但这些模型仅为一级生长模型,缺少实际应用的意义,但为下一步建立二级生长模型打下基础。王军等 [27]对我国猪肉产品致病微生物的污染状况及影响因素进行了调查,没有根据食品法典委员会(Codex Alimentarius Commission,CAC)的推荐步骤进行风险评估,也没有建立猪肉产品质量安全风险评估模型。董庆利等 [28]对某市开展了即食食品中单增李斯特菌的半定量风险评估,构建了即食食品中单增李斯特菌的风险矩阵,由风险可能性和风险损失度计算得到易感人群通过摄入即食食品感染单增李斯特菌的风险等级。骆璇等 [29]运用大量假设和@Risk软件对上海市猪肉中金黄色葡萄球菌进行定量风险评估,论文中存在大量不确定性,但为今后开展完善猪肉产品中金黄色葡萄球菌风险评估提供参考。基于OIE风险分析框架和FDA152号抗菌药物耐药性风险评估指南,马立才 [30]结合我国细菌耐药风险评估的现状建立了肉鸡源细菌耐药性定性风险评估模型。在评估过程中使用“矩阵法”和“非矩阵法”两种方法对风险参数进行整合。
5 启示
由于我国国家食品安全风险评估专家委员会成立较晚,各项工作仍处于起步阶段,食品风险评估工作与上述发达国家之间还存在很大差距,风险评估运行机制还不够完善。主要表现为:检测技术相对落后,专业人员不足,获得评估数据和评估结果缺少可信度,管理透明度和评估工作独立性有待于进一步加强。此外,风险评估标准多为从国外直接引入,没有真正地了解标准制定的详细过程、重要依据、现实情况以及国外的相关规定,导致了错误食品安全信息的存在和流传。风险评估中模块化过程中风险模型仅能评估当前风险而未能考虑流通领域的风险因素和危害溯源等缺陷,都需要我们进一步的改进。评估风险因素对食品产品安全的影响程度,管理者通过综合考虑控制效果和成本能够选择合适的风险控制措施,为企业在生产流通过程中预防和管理安全风险提供有力的工具,体现其应用价值 [31]。
我们要认识到动物及动物产品风险评估的作用十分重要:可以为动物的疫病的检测和预防提供基础信息;可以为动物产品标准的制定提供科学依据。为确定进一步的风险监测和管理的优先内容提供科学依据;一个政府制定的相关的食品安全管理措施,哪怕是一个标准,或者是一个规章制度,到底在实施以后有没有效果,都要在实施前后进行风险评估。
风险评估的技术在不断发展,我国也要不断借鉴国外的先进技术和经验,进一步的探索和完善我国的风险评估,应建立动物卫生风险评估管理机制,使风险评估可以发挥更大的作用。
动物医学论文范文 第2篇
题目:热应激对动物心肌细胞影响研究进展
摘要:热应激是动物饲养过程中经常遇到的难题,给畜牧业带来了较大的损失。由于心脏对热的敏感性较高,当动物机体遭受热应激损害时,首当其冲的器官往往是心脏。所以,如何提高心脏抵抗热应激的损伤,成为养殖业日益关注的焦点。论文从热应激对心脏的影响、心肌细胞在热应激作用下的组织形态学变化、热应激损伤心肌细胞的机制、热应激作用下心肌细胞的自我保护及如何提高心肌细胞对热应激的抵抗能力方面,结合近年来的研究做一综述。
关键词:热应激;心肌细胞;损伤
热应激(heat stress)是动物集约化饲养中经常遇到一大难题,给动物的生长、繁殖带来较大的损失[1]。例如笼养肉鸡常常因为受到急性热应激而猝死,即使在慢性热应激下也会因为食物消耗率低、代谢受阻而生长缓慢。
心脏是热应激较为敏感的器官。从宏观角度分析,当动物处于热应激状态下时,高温刺激体温调节中枢-下丘脑,并在下丘脑的调节下,机体加快散热,呼吸加快,体表血液流动加快,其心率也会加快,从而加重了心脏的负担,容易造成心肌损伤;从微观角度观察,有试验表明,心肌细胞在持续热应激作用下会发生严重的肿胀、变性[2]。当心肌受到损伤时,动物的健康也就受到了严重的威胁。所以,保护心肌细胞免受热应激的损伤成为当下研究热应激的热点之一。在国内外的研究中,持续的热应激往往造成心肌细胞的凋亡,然而热应激诱导心肌细胞凋亡的机制还不是很清晰。本文就近年来有关热应激对心肌细胞影响的研究进行综述,为探讨热应激对心肌的影响机制提供参考。
1 热应激对心脏的影响
心脏是动物机体循环系统中最重要的器官,当动物处于热应激状态下时,首当其冲的器官往往就是心脏。众所周知,当高温刺激下丘脑温度调节中枢时,机体表现出呼吸加快,心率加快,体表血液流速加快。持续的热应激会给心脏带来较大的负担,最终导致心脏衰竭。
有研究学者将肉鸡置于不同高温下,并在不同的时间段检测肉鸡股动脉压和右心室内压,发现股动脉压显著下降,且温度越高,股动脉压下降的速度越快;而通过记录不同时间段的右心室内压,可以计算出右心室内压的最大变化速率,右心室内压的最大变化速率可反映出右心室收缩和舒张的功能状态。实验表明右心室内压的最大变化速率显著下降,说明右心室在热应激作用下损伤严重[3]。
与上述试验相类似,高俊涛等[4]对SD大鼠做左心室插管手术,并检测可以反映心肌收缩力的等容收缩期左心室压力的最大值(left ventricular systolic pressure,LVSP)以及反映心脏功能状态的左心室等容收缩期压力变化最大速率(+dp/dt)等相关指标,发现在热应激初期LVSP,+dp/dt均逐渐升高,而1 h后两者均显著下降,反映出长时间的热应激造成左心室收缩力下降以及使心脏出现功能障碍的现象。提示,持续热应激会给动物心脏造成严重的损伤。
2 热应激作用下心肌组织形态学变化
处在热应激状态下的动物,经常会出现热休克和猝死现象。虽然这种热休克和猝死是由多种原因引起,但心肌细胞往往最先遭受到严重的热应激损伤。Wu Di等[5]将肉鸡置于热应激状态下并对其心肌细胞做组织切片观察,热应激1 h之后,发现心肌细胞出现肿胀状态;热应激5 h之后,出现心肌组织萎缩、心肌细胞核固缩;热应激15 h之后心肌细胞出现空泡变性、心肌纤维之间的间隙变大等特征。心肌组织的这种变化不仅仅出现在肉鸡中,Islam A等[6]通过对大鼠心肌细胞进行体外培养,然后将培养的心肌细胞放置在42℃环境下,观察心肌细胞在不同时间段内的变化,最终发现体外培养的大鼠心肌细胞出现与上述实验现象相似的组织形态学变化。提示热应激会给动物心肌组织造成严重的损伤。
3 热应激损伤心肌细胞的机制
根据上述心肌组织学变化可知,当动物长时间处于热应激状态下时,热应激损伤的最终结果是导致心肌细胞的凋亡。此外,心肌组织处在热应激下会在血清中释放一些重要的酶,如肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)和乳酸脱氢酶(lactate dehydrogenase,LDH)等[7],同时产生大量的自由基。通过检测血清中生化指标的变化,可以从侧面反映出心肌细胞在热应激作用下受到的伤害。
3.1 热应激作用下心肌组织内的生化指标的变化
CK和CK-MB在心肌组织中的含量丰富,两者联合LDH是检测心肌损伤的重要生化指标[8]。李昌武等[9]在试验中证实,当小鼠处在热应激状态下,其血清中的CK、CK-MB和LDH活力均呈上升趋势,提示心肌在热应激下而受损。这与仲庆振等[10]在研究急性热应激对鹅心脏损伤中所测得的CK活力上相一致,同样与井然等[11]所测得的高温环境中大鼠血清中LDH和CK-MB活力显著升高相一致。如此以来,便可以通过检测动物血清中相关酶的变化,方便而快捷的诊断出动物心肌细胞受到热应激损伤的程度,同时寻找降低这些酶活性的方法,便可以减轻热应激对动物心肌的伤害。
3.2 热应激诱导的心肌细胞凋亡机制
目前国内外研究中,关于热应激诱导的细胞凋亡机制还不甚清晰。Slimen I B等[12]指出热应激可以引起细胞的氧化应激,而氧化应激可通过多条途径介导细胞凋亡,提示热应激是通过多种途径诱导细胞凋亡的。最近有学者提出,较长时间的热应激可触发心肌细胞的内质网应激,进而进入内质网的信号凋亡途径[13]。然而,内质网的信号凋亡途径会与线粒体凋亡途径相汇合,其凋亡的最后一步依然由线粒体释放细胞色素C,激活caspase-3而最终导致细胞凋亡[14]。
王晓武等[15]将小鼠置于潮湿高温环境下,发现其心肌细胞凋亡率明显高于对照组,同时检测到血管紧张素Ⅱ(Ang Ⅱ)大量生成,而AngⅡ可通过P38 MAPK信号通路使caspase-3活化,以及联合湿热环境诱导的氧化应激产生高浓度的活性氧(reactive oxygen species,ROS),最终导致细胞凋亡[16]。由此可知,热应激既可以通过内源性通路,也可以通过外源性通路诱导细胞凋亡。
有研究发现热应激可以引起心肌细胞内钙离子超载以及机体的氧化应激,导致线粒体膜通透性的改变,并释放出细胞色素C,从而诱导心肌细胞的凋亡[17-18]。提示线粒体在心肌细胞中的重要作用,增强心肌细胞抵抗热应激引起的凋亡的,其关键就在于保护心肌线粒体。
4 热应激作用下心肌细胞的自我保护
众所周知,当细胞受到热应激或其他应激时,胞质内会迅速大量合成一类具有分子伴侣功能的蛋白质——热休克蛋白(heat shock proteins,Hsp)。同样,心肌细胞也能合成Hsp。其中Hsp70是得到广泛研究的一种热休克蛋白。Hsp70已经被证实可以抑制心肌细胞的凋亡,但其抑制凋亡的机制尚不清楚。
近年来Hsp70的抑制细胞凋亡的机制不断被发现,例如Hsp70可以抑制Fas介导的应激性心肌细胞凋亡[19]。然而,Hsp70在心肌细胞中的含量随着热应激时间的延长而逐渐降低,而当Hsp70降到最低水平时,心肌细胞也出现了严重损伤。提示Hsp70可能通过某种机制抵抗热应激对心肌的损伤[20]。心肌细胞内Hsp70水平随时间的变化与仲庆振等人的研究相一致[10]。提示,Hsp无法长期稳定的高表达也可能是持续热应激导致心肌凋亡的重要原因。
5 如何提高心肌细胞对热应激的抵抗能力
由于热应激对心肌细胞的损伤与动物机体其他组织细胞的损伤有一定的相关性,如热应激会增加机体ROS的含量,高浓度的ROS会诱导细胞的凋亡[16]。热应激作为非特异性应激反应,对动物机体的其他器官同样会造成严重的伤害。所以,提高心肌细胞对热应激的抵抗通常从动物整体水平上降低热应激的损伤。例如,通过降低环境温度来加快动物机体的散热;饲喂具有抗氧化作用的中药复方可显著降低动物血清中的ROS等。
我国学者曾通过对中草药的研究,寻求抗热应激的方法,并且取得了一定的效果。例如近年来发现水母雪莲可以显著降低热应激作用下的小鼠血清中心肌损伤标准物CK、LDH等的含量,从而减轻了热应激对小鼠心肌细胞的伤害[21]。
抗氧化剂可以清除机体内的ROS,从而达到抗热应激的目的,如维生素E、硒等。有学者发现维生素E可以通过增加心肌细胞内的金属硫蛋白的表达,从而实现抵抗热应激而保护心肌细胞目的[22]。近年来,在心肌组织中发现牛磺酸的含量非常丰富。牛磺酸具有清除ROS,降低血清中CK、LDH等心肌损伤标志物,抑制心肌细胞凋亡的作用[23],并且可直接作为饲料添加物而受到广泛关注。2000年发现的血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)可以水解Ang Ⅱ[24],从而保护心肌细胞免受Ang Ⅱ引起的细胞凋亡。
6 小结
综合近年来热应激对动物心肌细胞的影响研究可知,心脏很容易遭受到热应激的损伤。虽然心肌细胞可以通过合成Hsp进行短暂的抵抗,但长时间的热应激仍然可以给心肌细胞带来严重的伤害,甚至造成心肌细胞的凋亡。在动物饲养过程中,提高动物抵抗热应激的重要一环就是提高动物心肌对热应激的抵抗。但无论是在饲养条件方面,还是在营养水平上,都应尽量避免热应激的发生。从机体整体水平上减轻热应激损伤的同时,还应积极探讨热应激对心脏损伤的具体机制,寻找改善和提高心肌细胞抵抗热应激能力的方法。
参考文献:
[1] 刘志军,朱凤霞,万 锐.热应激对畜禽养殖的影响[J].中国兽医杂志,2014,50(9):53-55.
[2] 刘志军.热应激心肌细胞内Hsp110表达及其抗热应激性损伤机理研究[D].江苏南京:南京农业大学,2012.
[3] 李 静.37℃持续热应激对肉鸡血液动力学和酸碱平衡的影响[D].北京:中国农业大学,2004.
[4] 高俊涛,万 朋,王春艳,等.高温环境对大鼠心功能的损伤作用[J].环境与职业医学,2016,33(3):243-246.
[5] Wu Di,Xu Jiao,Song Erbao,et al.Acetyl salicylic acid protected against heat stress damage in chicken myocardial cells and may associate with induced Hsp27 expression[J].Cell Stress Chaperones,2015,20(4):687-696.
[6] Islam A,Lv Y J,AbdeInasir A,et al.The role of Hsp90 alpha in heat-induced apoptosis and cell damage in; primary myocardial cell cultures of neonatal rats[J].Genet Mol Res,2013,12(4):6080-6091.
[7] 秦海滨,朱 骞,张汇东,等.热应激对拉不拉多犬生理、激素、血液生化指标的影响[J].动物医学进展,2015,36(4):41-45.
[8] Amani M,Jeddi S,AhmadiasI N,et al.Effect of HEMADO on level of CK-MB and LDH enzymes after ischemia/reperfusion injury in isolated rat heart[J].Bioimpacts,2013,3(2):101-104.
[9] 李昌武,蔡 虹,张 华,等.热应激对小鼠心肌的影响和及其机制研究[J].动物生产,2013,49(7):72-75.
[10] 仲庆振,孙泽威,娄玉杰.急性热应激期间不同品种鹅心脏损伤及HSP70基因表达差异的研究[J].遗传育种,2014,50(9):19-22.
[11] 井 然,钱 捷,弓景波,等.热应激大鼠心脏损伤与血淋巴细胞热休克蛋白70的关系[J].环境与健康杂志,2012,29(10):881-883.
[12] Slimen I B,Najar T,Ghram A,et al.Reactive oxygen species,heart stress and oxidative-induced mitochondrial damage.A review.[J].Int J Hyperthermia,2014,30(30):513-523.
[13] Yang Y,Li C,Dai Z,et al.Ursolic acid prevents endoplasmic reticulum stress-mediated apoptosis induced by heat stress in mouse cardiac myocytes[J].J Mol Cell Cardiol,2014,67(67):103-111.
[14] 李 超,伏圣博,刘华玲,等.细胞凋亡研究进展[J].世界科技研究与发展,2007,29(3):45-53.
[15] 王晓武,袁彬彬,林 曦,等.湿热应激诱导小鼠心肌细胞凋亡的机制[J].基础医学与临床,2014,34(4):531-535.
[16] Wang X,Yuan B,Dong W,et al .Humid heat exposure induced oxidative stress and apoptosis in cardiomyocytes through the angiotensin II signaling pathway[J].Heart &Vessels,2014,30(3):1-10.
[17] Lingjia Q,Xueli S,Huirong R,et al.Mitochondrial mechanism of heat stress-induced injury in rat cardiomyocyte[J].Cell Stress Chaperones,2004,9(3):281-293.
[18] 吴 敏,朱 杰,贾明明,等.钙离子与氧自由基诱导损伤猪心肌细胞线粒体超微结构观察[J].动物医学进展,2014,35(5):62-67.
[19] Yun Z,Wanyin W,Lingjia Q.Hsp70 may protect cardiomyocytes from stress-induced injury by inhibiting Fas-mediated apoptosis[J].Cell Stress Chaperones,2007,12(1):89-95.
[20] Chen H B,Zhang X C,Cheng Y F,et al.Association of heat shock protein 70 expression with rat myocardial cell damage during heat stressinvitroandinvivo[J].Genet Mol Res Gmr,2015,14(1):1994-2005.
[21] 王 沛,邓淑凤,杨新华,等.水母雪莲对热应激小鼠心肌酶谱与心肌损伤标志物的影响[J].工业卫生与职业病,2014,40(3):172-174.
[22] Wang X,Dong W,Yuan B,et al.Vitamin E confers cytoprotective effects on cardiomyocytes under conditions of heat stress by increasing the expression of metallothionein[J].Int J Mol Med,2016,37(5):1429-1436.
[23] 张 悦.牛磺酸在大鼠心肌缺血模型中心肌保护作用的机制研究[D].上海:复旦大学,2013.
[24] 张瑜娟,杨维维,荣 超,等.血管紧张素转化酶2研究进展[J].动物医学进展,2016,37(1):72-76.
动物医学论文范文 第3篇
题目:探讨生态环境与动物医学
摘要:生态环境对动物生命活动及其致病因素的影响十分巨大而深远;动物的生命活动及其致病因素对生态环境影响直接而明显;两者相互关联、相互影响、相互作用、互為一个整体。因此动物医学应将生态环境从宏观上作为重要的研究对象,并在实践中采取综合措施才能既有效地控制疫病、又能保证生态环境。研究和应用生态环境与动物医学之间的关系,具有很重要的作用和意义。
关键词:生态环境 动物医学 应用
动物实验在医学研究中有着重要的意义,是医学研究中的重要方法。动物实验过程的运行管理,对于动物实验的 效果及科研成果尤其重要。我们做了100只家兔耳缘静脉的留置针输液实验,实验过程顺利,取得满意效果。现将其经验及做法总结如下。
一、动物的选择
1.动物来源确定 动物来源要选择国家、省相关部门确定的医学动物实验室,其中包括《实验动物管理条件》、《医学实验动物管理实施细则》的规定并取得医学动物实验条件的合格证明书。 其要求实验动物的同种属、同品系、同月龄、性别雌雄比例。
2 .熟悉并了解实验动物 在实验前,准备阶段要到相应动物实验室对参加实验的动物进行初步的观察、了解,主要观察其生活习性、了解饲养要求等,重点掌握实验的组织、器官等生理解剖部位、特点、并作初步评估。
二、预实验
预实验是对研究技术、方法的训练,对设计方案的实践评估,同时可以了解实验动物对各种处理因素的反应情况,以及在试验过程中,动物在生理、精神状态、饲养等方面可能出现的一些问题作以了解,以便在正式实验过程中作好提前的预防、分析,保证实验过程的顺利实施。
三、实验效果
动物实验要消耗一定的人力、物力、财力,所以对整个实验过程必须周密布置,诸如以上各项做法,尽最大限度地保 障动物实验的质量。以达到预期的目的。
四、讨论与分析
动物实验尽管有一定的不足,但在人体实验之前,动物实验是很重要的医学研究方法,因此,从事医疗科研人员应该更多熟悉、了解和掌握有关动物实验的基本知识和技巧,为临床科研工作做好基础。例如:
1.生态环境对动物生命活动及致病因素的影响作用
生态环境对动物种群结构的影响。不同地区、不同的生态环境,由于物种进化的直接原因导致了动物种群结构的不同。最直接的例子是农区与牧区从家畜家禽的品种、数量及生产性能上就明显不同。仅以牛为例,西部主要是牦牛及揙牛、中东部主要是黄牛而南方多为水牛。生态环境对动物种群结构的影响主要是受自然因素的制约。如不同的气温、海拔、日照、湿度、植物结构、降水、河流分布等等直接选择并影响了动物的品种。人们的生产生活对动物及其生命活动的选择也深刻地影响了动物种群结构。不同族群、不同的生活习俗、不同的信仰、不同的生产生活方式深刻地选择了动物的进化方向和动物的种群结构。如牦牛和麋鹿的饲养就体现了这种选择的影响。
生态环境对动物生命活动的影响。生态环境特别是自然环境影响着动物生命活动的每一个环节。我国西北牧区畜群的一个典型现象——“夏饱、秋肥、冬瘦、春死亡”就是这一影响的结果;我国的黄牛从东南到西北,从低海拔到高海拔,从平原到山区其产肉性能、泌乳性能及皮毛肉乳产品的质量差异也主要是这一影响的结果。人们的生产生活及需要直接干预了动物的整个生命活动。人们为了自身的需要直接干预动物的生命活动过程,其影响持续而且巨大。汉唐初期国家为了战争需要,全国大规模饲养战马;改革开放以来,大量引进国外奶牛、生猪及家禽,使我国本地畜禽品种数量锐减甚至个别消失;为了提高产量,人们大量采用人工授精技术、采用规模化养殖方式等等技术,使动物的每一个生命活动都受到人为的干预,其影响和结果差异十分明显。
2.动物生命活动及病源微生物对生态环境及人们生产生活的影响
动物生命活动对生态环境的影响。生物链对生态环境的影响十分明显,进化论及生态学都证明了生物链中任何一环的失衡对生态环境的影响都十分巨大。例如物种之间的竞争、物种内部的竞争都直接影响着生态环境。动物的个体生命活动、群体生命活动对生态环境的影响和作用相当深刻。例如动物的季节性迁徒、动物的排污,特别是动物的疾病、死亡及尸体对生态环境的影响与作用是直接而明显的。
病源微生物对生态环境及人们生产活动的影响。长期以来,人们一直把致病因素作为负面的对象进行研究,其实致病因素特别是病源微生物本身就是生态环境中最基本的一环,是微生态环境中最重要的一环。动物疾病的发生从本质上讲是致病因素在生态环境中从微观到宏观的水平上失衡导致的。因此动物致病因素深刻而且巨大地影响着生态环境中动物的生命活动,使其个体、群体在微观和宏观水平上失衡。利用病源微生物在生态环境中的作用可以深刻地影响人类活动。人们利用牛痘预防天花,现在人类已消灭了天花;青霉素的生产和使用挽救了无数人的生命,但现在的滥用又给人类和环境造成了巨大的危害。
总之,由此可以看出生态环境与动物的生命活动及致病因素之间是相互联系、相互作用、相互影响的一个有机的统一整体。传统动物医学的目的是控制并治疗好疾病,而研究和利用动物环境医学的目的是怎样不让动物及其群体生病或尽可能少地生病,因此研究和利用动物环境医学具有深远的作用和意义。所以动物医学在研究对象上应该从宏观角度把生态环境作为一个整体来进行,才能准确地把握疾病的发生、发展及流行方式,才能综合采取措施,做到既能防控病症,又能保证生态环境,只有这样才能使畜牧业健康持续科学地发展,而不是一味地追求畜牧经济存量及利益的最大化。因此研究和应用生态环境与动物医学之间的关系以指导畜牧业生产、约束人们的生产生活方式、达到最佳的疾病防控目的,具有极其重要的意义和作用。
参考文献:
[1] 李杰,.动物医学专业校内实训基地建设的模式研究[J].黑龙江畜牧兽医,2007(23):187-189.
[2]王丹,黄志坚.动物医学和动物科学专业学生毕业实习管理的思考和对策[J].中国林业教育,2009(3):15-17.
动物医学论文范文 第4篇
题目:牛病毒性腹泻病毒检测方法研究进展
牛病毒性腹泻(Bovine viral diarrhea,BVD)是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的以高热、腹泻、怀孕母牛流产或胎儿畸形、口腔和消化道黏膜糜烂、坏死及血小板和白细胞减少为主要特征的接触性传染病[1]。BVDV的自然宿主是牛,感染怀孕牛后,可导致持续性感染(persistent infection,PI)牛犊的出生,PI牛在整个生存周期持续排出大量感染性病毒颗粒,是易感动物感染病毒的主要来源。目前BVD呈全球性分布,给各国的养牛业造成了严重的经济损失,急性感染的病牛导致的损失达每头牛46.5美元[2]。
BVDV包括BVDV-1、BVDV-2两种基因型,每种基因型都包括致细胞病变型(cytopathic,CP)和非致细胞病变型(non-cytopathic,NCP)两种生物型。根据5’-UTR、Npro和E2基因序列的差异,将BVDV-1分为至少22个基因亚型,将BVDV-2分为4个基因亚型。BVDV在我国各个省份均有流行,且流行形势较为复杂,新疆、云南等地部分牛场的BVDV阳性率达60%以上[3-4]。有些地区牛群中甚至同时流行多种亚型[5]。当前,BVDV的防控主要依靠疫苗免疫及清除PI牛,而如何准确对BVDV感染牛及PI牛进行鉴别诊断显得尤为重要。本文综述了国内外BVDV检测方法的研究进展,以期为BVD的防控和净化提供参考。
1 病原学诊断
1.1 病毒的分离鉴定
各种牛源细胞均可用于BVDV的分离培养,目前最常用的是传代牛肾(MDBK)细胞。将病毒分离材料,如牛血清样本、分泌物、排泄物等经过处理后接种MDBK细胞,如是致细胞病变型毒株,可在接种细胞后的最初几代内出现皱缩、变圆、拉网、脱落,聚集后产生合胞体和巨细胞等现象即可初步确定为BVDV。而非致细胞病变型毒株,则需盲传3代~5代,最终结合免疫荧光等方法确定病毒分离成功。BVDV的分离鉴定是最基础的检测BVDV的技术,是鉴别BVDV感染的“金标准”,该项技术不需要特殊的仪器设备,仅进行细胞培养即可。但该方法操作周期较长,不能满足BVDV快速检测的需求,且不适用于大量样本的检测。此外,该项技术对细胞、血清的要求较高,特别是近些年作为细胞分离培养原材料之一的胎牛血清中BVDV污染较为严重,较大程度限制了该方法的使用。目前有研究人员使用异源血清进行分离培养[6]。
1.2 电镜检查
电镜检查是观察BVDV颗粒的经典方法,常用的有直接电镜技术和免疫电镜技术。直接电镜技术对BVDV样本的量要求较高(约107个/mL),观察到的BVDV颗粒通常是散在的,但可观察到病毒粒子的自然形态。李祯等[6]在透射电镜下观察到直径为40 nm~60nm的球形、外被囊膜的BVDV颗粒。而免疫电镜技术通常可见到大量的BVDV颗粒聚集在一起。王冶才等[7]利用免疫电镜技术,观察到大小不等的BVDV粒子。相较于直接电镜技术,免疫电镜技术敏感性更好,且可更快速地观察到病毒粒子。近些年又发展出检测BVDV的蛋白A胶体金免疫电镜技术,相较于传统的直接电镜技术和免疫电镜技术,该技术敏感性更高,更快速。但不管是哪种电镜技术,均需专业人员使用专业的仪器设备进行操作,检测成本较高,且检测时间较长,仅适用于初筛为BVDV阳性样本的确认,该方法只能用于BVDV的实验室检测,无法推广到基层。
2 血清学方法
2.1 血清中和试验
血清中和试验是对BVDV或抗体进行定性或定量分析的一种方法,在实际操作中,可对疑似感染牛间隔3周~4周前后采血2次,测定血清的中和抗体效价,如果第2次高于第1次4个滴度以上可判为阳性,2个滴度以上,视为疑似患病。该方法敏感性高、特异性好、可重复性强,是世界动物卫生组织(WOAH)推荐的检测BVDV抗体的标准方法之一,广泛用于BVDV的血清学调查。但在检测抗体时,因BVDV不同基因型及基因亚型的抗原性存在差异,抗原的选择会对抗体滴度的精确定量存在影响[8],且由于持续性感染牛对病毒缺乏免疫应答而不产生抗体,在进行血清中和试验时会因为阴性结果而造成误判。此外,该方法操作较为繁琐,周期长,费时费力,目前仅用于BVDV的实验室检测。
2.2 酶联免疫吸附试验
目前检测BVDV的常用酶联免疫吸附试验(ELISA)包括间接ELISA、双抗体夹心ELISA、阻断ELISA、斑点酶联免疫吸附试验(Dot-ELISA)、葡萄球菌A蛋白的酶联免疫吸附试验(PPA-ELISA)、单层酶联免疫吸附试验(M-ELISA)及细胞内酶联免疫吸附试验(In Cell-ELISA)等。
2.2.1 间接酶联免疫吸附试验 间接酶联免疫吸附试验是检测BVDV抗体的常用方法,可用于检测样品中BVDV总抗体的浓度。但采用全病毒作为包被抗原需对BVDV大量增殖后进行浓缩和纯化,难度较高。为弥补这一缺点,可采用重组蛋白作为包被抗原,其中结构蛋白Erns和E2及非结构蛋白p80因免疫原性较强,常作为包被抗原。陈瑞红[9]将3种蛋白分别进行原核表达并建立ELISA方法,通过比较,认为重组蛋白E2作为包被抗原建立的间接ELISA方法更为特异。
2.2.2 双抗体夹心酶联免疫吸附试验 捕获抗体和检测抗体一般由不同种属的动物制备,如应用单克隆抗体,一般选择2个针对BVDV不同抗原决定簇的单克隆抗体。胡俊英等[10]制备了抗BVDV E2蛋白的单克隆抗体和多克隆抗体,并以此建立了基于单克隆抗体捕获BVDV抗原的双抗体夹心ELISA方法,动物感染病毒后可通过检测其粪便排泄物的BVDV抗原作出早期诊断。丁金华[11]与周子恒[12]分别利用纳米抗体和多克隆抗体建立基于抗BVDV纳米抗体双抗体夹心ELISA检测方法,用于检测BVDV,虽然方法在敏感性方面存在问题,检测效果不理想,但将纳米抗体引入ELISA方法的建立过程,仍为BVDV检测方法的改进提供了新思路。
2.2.3 阻断酶联免疫吸附试验 阻断酶联免疫吸附试验也称竞争ELISA,当待检样品无法提纯或不能进行稀释时,可用此法检测BVDV特异性抗体。王新平等[13]建立了双抗体夹心阻断ELISA方法,并对长春地区293头奶牛和262头黄牛的血清样品进行测定,结果显示,黄牛抗体阳性率高达43.5%。但阻断ELISA的缺点是操作较为繁琐,用时较长。
2.2.4 斑点酶联免疫吸附试验 斑点酶联免疫吸附试验是一种经济、快捷,可肉眼直接判定的ELISA方法,适合BVDV的临床诊断及抗体监测。Zhao Y L等[14]建立了检测BVDV抗体的间接Dot-ELISA,与Idexx ELISA试剂盒相比,该方法的特异性、敏感性和准确性分别为96.7%、92.5%和95%。
2.2.5 葡萄球菌A蛋白的酶联免疫吸附试验 葡萄球菌A蛋白的酶联免疫吸附试验是利用辣根过氧化物酶标记的葡萄球菌A蛋白代替酶标二抗建立的ELISA方法,其优点是可用于多种哺乳动物抗体的检测。柴顺秀等[15]利用BVDV重组E2蛋白建立了检测BVDV血清抗体的E2-PPA-ELISA方法,结果显示与Idexx ELISA试剂盒的检出率无显著差异。
2.2.6 单层酶联免疫吸附试验及In Cell酶联免疫吸附试验 单层酶联免疫吸附试验是将细胞培养与ELISA结合的检测技术。研究人员通过比较发现,检测BVDV时,M-ELISA与病毒分离试验敏感性无显著性差异,但比免疫过氧化物酶单层试验(IPMA)方法更快速,且更客观。In Cell-ELISA是一种用于检测和分析BVDV感染的新方法,将BVDV的传染性标准化为培养细胞的数量,可用于CP和NCP毒株的检测[16]。ELISA方法是目前检测BVDV应用最广泛的方法之一,与经典的病毒分离等方法相比,该方法可同时对批量样本进行检测,且对仪器设备和试验人员的要求较低。但利用ELISA方法进行BVDV抗体检测时,容易受到母源抗体的干扰,且与同属的猪瘟病毒(Classical swine fever viru,CSFV)之间存在交叉反应,也不能对PI牛进行筛选。
2.3 免疫荧光技术
检测BVDV常用的方法有直接免疫荧光技术和间接免疫荧光技术。直接免疫荧光技术即将荧光素标记在抗体上,直接与BVDV抗原发生反应。优点是简便快捷,特异性高,非特异性染色少,缺点是敏感性低,且标记的抗体需达到一定浓度,否则荧光太弱,影响结果的观察。此外,有研究表明BVDV基因型及抗原差异对直接免疫荧光试验影响较大[17]。间接免疫荧光方法较直接免疫荧光方法敏感性提高,该方法与血清中和试验、病毒分离试验的结果高度相关,且敏感性高于抗原捕获ELISA,更适合用于血清中BVDV抗原的检测[18-20],但其缺点是容易产生非特异性荧光。不管是直接方法还是间接方法,都需要使用荧光显微镜,对仪器设备的要求较高,一般仅用于BVDV的实验室检测,无法用于基层检验。
2.4 琼脂扩散试验
琼脂扩散试验灵敏度不高,与微量中和试验的阳性率之间差异极显著(P<0.01)[21],且仅能检测出BVDV群特异性抗体,与CSFV存在交叉反应。不能用于BVD的精确诊断,尽管如此,因琼脂扩散试验操作简便,无需特殊的设备或试剂,可用于大量血清样本的检测,常作为基层BVDV检测的初筛方法。
3 分子生物学方法
3.1 核酸扩增
3.1.1 RT-PCR 目前已广泛用于BVDV的鉴定、分型及遗传进化分析,对CP型和NCP型毒株均可检测,该方法特异性高、敏感性强、检测周期短,能批量检测临床样本,且多次检测时可筛选出群体中的持续性感染动物[22],对于BVDV的防控具有重要意义。随后,在普通PCR的基础上,研究人员又建立了套式RT-PCR及可同时检测BVDV与常见牛腹泻疾病的双重或多重RT-PCR方法,检测灵敏度高于普通PCR[23],且大大提高了检测效率,降低了检测成本。但普通RT-PCR只能定性分析,需通过琼脂糖凝胶电泳判定结果,在操作过程中常因气溶胶污染出现假阳性,且存在非特异性条带时容易产生误判。因此,在操作时应严格设置阴阳性对照,保障结果的准确性。虽然该方法应用广泛,但因需要PCR仪,尚无法推广到基层进行使用。
3.1.2 荧光定量RT-PCR 在普通RT-PCR基础上,研究人员建立了检测BVDV的荧光定量RT-PCR方法,敏感性显著高于RT-PCR[24],且能定量分析待检样品。加入反应体系后不必打开反应管,一定程度上避免了气溶胶污染。但该方法需要荧光定量PCR仪,仪器的使用和维护成本较高,试剂和耗材也高于普通PCR仪,仅可用于BVDV的实验室检测。
3.1.3 RT-LAMP 近年来,随着环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)的发展,研究人员建立了可用于BVDV检测的RT-LAMP检测方法,该方法虽然与病毒分离方法的阳性率差异较大,但与Idexx抗原捕获ELISA方法的阳性率无明显差异[25],且从试验设计复杂程度、扩增反应效率、使用仪器简单程度及检测成本等方面均优于荧光定量RT-PCR和普通RT-PCR[26],更适合用于基层BVDV的快速检测。范晴等[27]在RT-LAMP的基础上,在LAMP引物中标记荧光基团,建立了二重荧光RT-LAMP,反应后通过扩增产物的颜色读取反应结果,可准确鉴别检测BVDV和牛轮状病毒(Bovine rotavirus,BRV)两种病毒,解决了国内多重LAMP方法不能准确检测是哪种病原而引起阳性结果的问题。
3.1.4 纳米PCR 纳米PCR是一种新型的PCR技术,敏感性高于常规PCR,可用于BVDV的快速检测。刘泽余等[28]利用该技术对吉林省部分省界地区的血清样品及临床组织病料进行检测,共检测出150份阳性血清样品,BVDV阳性率为19.21%。
3.1.5 重组聚合酶扩增-侧向试纸条检测 该技术简称为RPA-LFD。重组酶聚合酶扩增(recombinant polymerase amplification,RPA)被认为是可以替代PCR的核酸检测技术,侯佩莉等[29]针对BVDV 5’UTR序列,建立了一种BVDV RPA-LFD检测方法,检测限达2TCID50,与WOAH推荐的实时荧光PCR方法检测限一致。
3.2 核酸探针杂交技术
3.2.1 核酸探针杂交技术 广泛应用于病毒或细菌的基因检测。根据标记物的不同,一般将核酸探针分为两类:一类是放射性同位素标记探针(如32P等),一类是非放射性物质标记核酸探针(如生物素、地高辛等)。因放射性同位素具有放射危害且半衰期短、不稳定,目前BVDV的检测常用的是非放射性物质标记核酸探针。杂交试验可以检测CP型和NCP型毒株,且敏感性比BVDV感染试验强10倍~100倍[30]。值得注意的是,针对BVDV基因组不同区域的探针,检测率存在差异,针对5’末端的探针检出率高于其他区域[31-32]。随着纳米技术的发展,Heidari Z等[33]建立了交联与非交联金纳米杂交试验,可直接检测BVDV,无需扩增,检测灵敏度可达每反应6.83 ng和44.36 ng,两种方法成本低廉,操作简单,可用于BVDV临床样本的检测。核酸探针杂交技术操作简便、特异性高、敏感性强,结果准确,可在同一张膜上进行几个甚至上百个样品的检测,可用于BVDV大量样本的快速检测,但单个样品的检测成本较高。
3.2.2 基因芯片技术 基因芯片技术是分子杂交技术的发展,与传统的核酸分子杂交技术相比,该方法可实现样品的高通量检测,并能同时检测多种病原,由于该方法的反应体积小,大大降低了检测成本,能用于BVDV大规模的检测筛选。随后,高峰等[34]将LAMP技术与微流控芯片技术有机结合,可同时检测包括BVDV在内的5种病原,为口岸检疫探索出一种快速、高通量检测动物疫病的方法。而魏春霞等[35]建立了一种可视化基因芯片检测方法,具有高通量、高灵敏度、高特异性等特点,可在3 h内完成同时对包括BVDV在内的7种牛重要疫病病原的检测,在牛群疫病诊断、净化及流行病学调查等方面具有良好的应用前景。
4 结语
BVDV是影响全球养牛业的主要动物疫病病原之一,在我国感染范围广泛,且具有遗传多样性。准确鉴别检测BVDV,以了解该病在我国的流行现状及主要流行毒株,同时筛查并清除PI牛,为我国BVD的防控及净化提供理论依据及技术支持。目前,诊断BVD的方法很多,每种方法都有适用性,也有局限性,应根据检测目的的差异,选择不同的方法,如牛场临床样本的初筛可选择琼脂扩散试验、ELISA试验及RT-PCR;出入境口岸可选择基因芯片技术、多重荧光定量RT-PCR等高通量检测方法,可快速检测多种病原;对于可疑样本可选择病毒分离培养、免疫荧光及电镜检查等方法进行最终确定,并利用RT-PCR进行遗传进化分析。实际工作中,往往选择几种检测方法对同一样本进行检测,以避免假阳性或非特异性结果的出现。随着分子生物学技术的不断发展,相信会有越来越多更加敏感、特异、快速的检测方法的建立,为BVDV的精准防控奠定基础。
动物医学论文范文 第5篇
题目:高压氧在治疗犬和猫肾衰竭中的应用
慢性肾功能衰竭是在发生各种慢性肾脏疾病基础上,由于肾单位逐渐受损,缓慢发展的肾功能减退以致不可逆转的肾衰竭。该病主要表现为肾功能减退,代谢废物(尤其是蛋白分解后的含氮代谢产物)潴溜,水、电解质和酸碱平衡失调,与肾脏有关的多种内分泌功能失调,以至于不能维持机体内环境的稳定而引发的临床综合征。慢性肾衰竭是犬和猫最常见肾脏疾病,是犬的第三大致死因素,猫的第二大致死因素,最常发生在5岁以上的犬和猫。高压氧治疗(hyperbaric oxygen therapy,HBOT)是在超过一个大气压的氧舱中呼吸纯氧气以达到治疗目的治疗方式。本文主要介绍临床接诊的30例肾衰竭病例,通过常规输液治疗配合高压氧治疗前后相关指标的变化情况。
1 材料与方法
1.1 材料
1.1.1 动物 来我院就诊的30例临床肾衰竭,其中犬15例,猫15例。年龄最小2岁,最大12岁。
1.1.2 主要仪器 高压氧舱,上海宝邦医疗器械有限公司产品;血气分析仪,雷度米特医疗设备有限公司产品;兽用全自动血液细胞分析仪,深圳迈瑞生物医疗电子股份有限公司产品;VET Chroma(维克玛)荧光免疫分析仪,韩国 ANIVET公司产品;全自动生化分析仪,天津微纳芯科技有限公司产品。
1.2 方法
1.2.1 一般检查 精神沉郁,活动力差,体况差(体况评分均小于4/9)。可视黏膜粉红色,口臭,有牙龈炎及牙结石,毛细血管再充盈时间大于2 s,均出现不同程度脱水,皮肤被毛干燥,触诊浅表淋巴结正常。
1.2.2 实验室检查 包括血常规检查,急性反应蛋白C反应蛋白(淀粉样蛋白),血液生化,血气等。
1.2.3 治疗 对上述病例进行治疗,治疗主要包括常规治疗和高压氧治疗。常规治疗主要是根据个体情况进行抗菌消炎,补充能量,纠正水、电解质、酸碱平衡以及其他对症治疗。而高压氧治疗则按照每次高压氧1 h,每日1次,5次为一疗程,治疗最短1个疗程,最长4个疗程。15只猫和15条犬分别在1个疗程后进行相关血液项目检测。
2 结果
患病动物治疗前血常规检测结果显示,血液白细胞数升高及红细胞数降低。C反应蛋白(淀粉样蛋白)含量均出现升高,最高为257.79 mg/L(正常指标<10 mg/L)。治疗后白细胞数及红细胞数趋于正常,C反应蛋白(淀粉样蛋白)含量出现不同程度的降低。
15只猫和15条犬治疗前后血液生化和血气结果见表1和表2。治疗后肾脏指标均出现不同程度的降低,血气检测体内酸中毒转归甚至消失,取得了较为满意的治疗效果。在治疗过程中,8例死亡,15例指标恢复正常,7例继续坚持高压氧治疗。
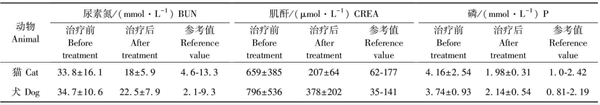
表1 治疗前后部分生化肾功指标对比
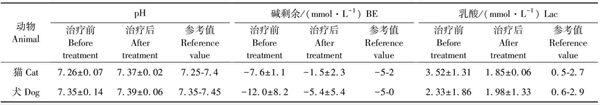
表2 治疗前后血气主要指标对比
3 诊疗体会
高压氧治疗在人医上应用时间比较长,近几年才开始进入动物诊疗。关于高压氧在动物治疗应用方面的文献报道比较少,之前有报道的也是高压氧在脊髓损伤、肺损伤、伤口愈合等方面的文献[1-5]。
人医上关于高压氧治疗肾脏疾病的研究比较早[6-7]。Ivanov M等[8]及商昌欢等[9]发现高压氧对肾脏的缺血再灌注损伤有保护作用。其机制主要是通过增加血液中氧的物理溶解量,提高组织氧分压,以纠正机体缺氧或促进细胞有氧代谢,从而改善缺血组织的灌注情况、促进损伤组织的恢复。从分子生物学研究发现高压氧可以减少肾小管上皮坏死细胞凋亡,从而发挥保护肾脏的作用[10-14]。陈北方等[15]研究发现高压氧可以增加血液和尿液中的SOD(肾脏抗氧化酶的一种)水平,从另一个方面解释高压氧治疗慢性肾功能衰竭的可能机制。
在临床治疗犬和猫急慢性肾衰时,HBOT是首推的辅助治疗方法之一。高压氧治疗使得肾功指标和血气指标改善的可能机制是HBOT时肾血流减少,肾小球滤过率增加,有助于代谢废物的清除和电解质及酸碱平衡的维持;增强机体抗氧化能力,减少组织的氧化损伤;有利于修复和新生血管的生发,有利于肾脏局部微循环的重建及其功能的恢复。HBOT环境下使机体处于富氧状态,能有效缓解缺血再灌注对肾脏的损伤,能促进机体的新陈代谢,对肾脏新生血管的生发和组织修复存在多方位的保护作用,有助于急慢性肾病的治疗和转归。高压氧与常规治疗结合,加速病患愈合转归,起到事半功倍的效果。
动物医学论文范文 第6篇
题目:抗鸡球虫病基因重组疫苗的研究进展
鸡球虫病(Avian coccidiosis)是由顶复门(Apicomplexa)孢子纲(Sporozoasida)艾美耳科(Eimeriidae)艾美耳属(Eimeria)的多种球虫引起鸡的一种肠道原虫病,球虫主要寄生于鸡的肠上皮细胞内,初次在禽类肠道发现距今已有100多年历史,其对鸡的危害十分严重。鸡球虫病在世界各地均有发生每年造成的全球经济损失超过35亿美元[1]。鸡感染球虫后会表现出血性、坏死性肠炎和血痢等症状[2]。同时,球虫的亚临床感染也十分常见,多影响食物转化率、平均日增重和出栏时间等关键生产参数。
目前鸡球虫病的防控主要依赖化学抗球虫药、活卵囊疫苗和饲养管理等策略。随着抗鸡球虫病药物的大量使用,耐药虫株日渐增多,药物残留等弊端也日益明显,大大限制了抗鸡球虫病药物的应用[3]。免疫预防在后抗生素时代逐渐成为控制鸡球虫病的替代方法。目前的抗鸡球虫病疫苗主要以强毒或减毒活卵囊疫苗为主,但二者都存在一定的缺陷[4],强毒活卵囊疫苗不适当的使用可能会导致球虫病暴发或将新的强毒球虫虫株引入养殖场,而弱毒活卵囊疫苗存在毒力返强的风险;此外,所有活卵囊疫苗的应用都属于感染性免疫,存在影响免疫鸡体肠道健康的潜在危机。因此,新一代安全高效的球虫防控策略亟待改善。
随着各种基因工程技术的发展,疫苗研究的方向正逐渐从传统灭活苗和弱毒苗向基因工程疫苗过渡。目前正在研发或已应用于生产实践的基因重组疫苗主要包括核酸疫苗、亚单位疫苗、活载体疫苗和合成肽疫苗等[5]。与传统疫苗相比,基因重组疫苗具有安全、稳定、高效、易于制备等特点。在本综述中,总结了现有的抗鸡球虫病措施,探索了可用于重组抗鸡球虫病疫苗的候选方案。
1 当前抗鸡球虫病主要措施
1.1 抗鸡球虫病药物
大量研究表明,药物仍是防治球虫病的主要措施与手段。当前抗鸡球虫病药物(表1)包括聚醚类离子载体抗生素、化学合成药[3]及中草药。

表1 常用抗球虫药
聚醚类离子载体抗生素由放线菌(Actinomaduraspp.)或链霉菌(Streptomycesspp.)发酵产生,主要作用于球虫无性繁殖与有性繁殖阶段,通过干扰球虫细胞内阳离子的正常交换,破坏细胞内外渗透压,致使细胞死亡。由于其具有广谱抗鸡球虫病作用,被广泛应用于养鸡业。
化学合成类抗鸡球虫病药主要通过抑制球虫线粒体呼吸作用、干扰球虫二氢叶酸的合成或竞争性抑制硫胺摄取等方式来阻滞球虫的正常发育。
近年来,球虫对聚醚类抗生素和化学药物的耐药愈发普遍。研究发现,我国各地的柔嫩艾美耳球虫对聚醚离子载体类抗生素和化学抗鸡球虫病药物呈现不同程度的耐药性[6]。黄仪娟[7]等通过对分离得到的6株鸡艾美耳球虫虫株进行耐药性试验,发现6株虫株均呈现中度或重度耐药。
尽管抗鸡球虫病药物在鸡球虫病的防控中发挥着巨大作用,但不可避免的耐药性问题以及当前全面减抗替抗背景下对抗鸡球虫病药物使用的限制,消费者对食品中化学残留物的担忧,阻碍了大多数抗鸡球虫病新药的开发。
1.2 活卵囊疫苗
艾美耳球虫活卵囊疫苗由未减毒或减毒的艾美耳球虫虫株研制而成,可以有效替代化学药物用于预防鸡球虫病,鸡在摄入和循环受控剂量的疫苗卵囊后,可以获得坚强的免疫保护[8]。由于疫苗株的生产需要通过在鸡中独立传代多次,抗鸡球虫病疫苗在家禽业的应用受到了很大限制。对于生产能力的高要求,也意味着疫苗成本远高于抗鸡球虫病药[5]。
活卵囊疫苗也存在一定的缺陷。接种疫苗有引入新虫株的风险;活卵囊会引起鸡轻微肠道病变,影响饲料转化率;由于球虫卵囊较大,易沉积,添加悬浮剂后若不混匀,极易造成免疫不均,影响免疫效果。在免疫期间禁止使用抗球虫药,饲料中也不能含有抗球虫药物。以上因素的存在限制了球虫疫苗在养殖户中的广泛应用。
1.3 基因重组疫苗
基因重组疫苗主要有核酸疫苗、亚单位疫苗和活载体疫苗等 。核酸疫苗是将含有编码抗原基因序列的质粒载体,通过肌肉注射或用基因枪等导入宿主体内,被宿主的组织细胞、抗原呈递细胞或其他炎性细胞摄取,抗原蛋白在宿主细胞内表达,诱导产生特异性免疫应答,从而达到防治疾病的目的[9]。亚单位疫苗是通过基因重组技术,调取病原微生物保护性抗原基因并导入表达系统,在其高效表达后提取保护性抗原,加入佐剂制成的重组亚单位疫苗[10]。CoxAbic是第一个商业化的球虫病亚单位疫苗。由从巨型艾美耳球虫(E.maxima)分离到的亲和纯化的配子母细胞抗原(affinity purified sexual stage (gametocyte) antigens,APGA)组成[11]。接种蛋鸡后其抗球虫作用可通过蛋垂直传播给下一代。活载体疫苗主要是利用分子生物学手段,将目的抗原的编码基因导入细菌或病毒活载体,随着重组菌(毒)株在宿主体内增殖,目的基因大量表达,从而诱发相应的免疫保护应答[12]。自20世纪80年代有关于重组疫苗开发的报道以来,多个研究小组已经尝试和试验了多种候选抗原。据报道,在免疫球虫抗原重组蛋白、重组球虫抗原DNA疫苗及联合病毒活载体的球虫抗原疫苗的小规模试验中,球虫卵囊计数或肠道损伤评分降低了30%~90%,或者在饲料转化率或相对增重率方面得到了改善[13]。
2 抗鸡球虫病基因重组疫苗研究进展
当前抗鸡球虫病基因重组疫苗的研究主要集中于抗原蛋白的选择与细胞因子佐剂的联合使用。同时,艾美耳球虫复杂的抗原多样性对基因重组疫苗的研制造成了一定的阻碍,选择合适的抗原是开发新型基因重组疫苗的关键。
2.1 候选抗原蛋白分子研究进展
在宿主与虫体互作中发挥重要作用的蛋白被确定为抗鸡球虫病疫苗候选蛋白,这是由于这些蛋白在球虫入侵与增殖过程中自然暴露,因此可以作为宿主免疫应答的靶标[10]。
研究最广泛的是微线体蛋白,微线体位于顶复门寄生虫顶端,可分泌顶膜抗原(apical membrane antigen,AMAs)、微线体蛋白(microneme proteins,MICs)等,对寄生虫的滑行运动与黏附宿主细胞以及进出受感染细胞至关重要[14]。MICs在入侵早期分泌,帮助寄生虫附着于宿主细胞,为入侵创造平台[15]。对柔嫩艾美耳球虫的蛋白质组进行分析,发现AMAs蛋白在子孢子阶段和裂殖子阶段均存在。研究发现AMA1是子孢子入侵宿主的关键蛋白,是形成虫体与宿主细胞间环形运动结合体(moving junction,MJ)不可缺少的一部分[16]。
SO7蛋白又称RB1或GX3262,位于子孢子折光体上,作为重组蛋白、核酸疫苗或以鼠伤寒沙门氏菌为载体时,可诱导部分保护性免疫。研究发现柔嫩艾美耳虫重组折光体蛋白EtSO7能有效诱导免疫鸡产生细胞和体液免疫反应,对盲肠感染球虫的鸡有明显的保护作用[17]。
TA4蛋白位于柔嫩艾美耳球虫子孢子表面,研究发现抗TA4抗原的单克隆抗体会对鸡球虫子孢子入侵细胞产生抑制作用,表明TA4抗原可能在球虫入侵宿主细胞过程中发挥重要作用[18]。近年来大量研究也证实,以 TA4 基因编码的蛋白免疫鸡只,能够收到良好的抗球虫效果。IMP1定位于子孢子细胞膜,现已作为候选抗原被广泛研究。近年来,IMP1蛋白被先后确定为巨型艾美耳球虫和柔嫩艾美耳球虫的疫苗候选分子[19-20]。3-1E蛋白是研究最多的抗鸡球虫病亚单位疫苗抗原。其主要与肌动蛋白单体结合,延缓肌动蛋白聚合作用,同时也在弓形虫的滑行运动中发挥重要作用。它还是Toll样受体(Toll-like receptor,TLR)5、11和12的配体,这些受体在许多胞内病原微生物(如弓形虫)的免疫反应中发挥关键作用[21],这表明3-1E蛋白可作为一种新的黏膜佐剂。研究发现免疫艾美耳球虫3-1E蛋白增强了小鼠对急性静脉病毒感染的抵抗力[22]。将艾美耳球虫3-1E蛋白、产气荚膜梭菌NetB蛋白与Montanide IMS佐剂联合应用,在巨型艾美耳球虫和产气荚膜梭菌共感染动物试验中,增强了对于坏死性肠炎的抵抗效果[23]。
乳酸脱氢酶(lactate dehydrogenase,LDH)作为无氧糖酵解途径的末端酶,对寄生虫在宿主体内的生命活动有较大影响。研究表明,每种球虫仅有一种LDH,因此常被用以鉴别艾美耳球虫虫种。分析柔嫩艾美耳球虫(E.tenella)、巨型艾美耳球虫(E.maxima)和堆型艾美耳球虫(E.acervulina)的LDH氨基酸序列,发现其同源性为66%~80%,且其蛋白表达水平在球虫发育各阶段无明显差异,具有作为疫苗候选抗原的潜力[24]。
2.2 细胞因子佐剂研究进展
细胞因子具有广泛的生物学活性,在调节固有免疫和获得性免疫中发挥着关键作用,由抗原或其他刺激剂诱导多种细胞产生。大量研究表明将细胞因子作为佐剂与球虫疫苗联合使用,可以调节免疫细胞活性,增强疫苗的免疫保护力和机体的免疫水平。通过将球虫保护性抗原与相应细胞因子连接构建表达载体,可以有效改善基因重组疫苗的缺点。
白介素(IL-2、IL- 12、IL-18)、干扰素(IFN-α、IFN-γ)和肿瘤生长因子(tumor growth factor,TGF)b4等被广泛用作基因重组疫苗的佐剂。在加入IFN-α和淋巴细胞趋化因子后,感染堆型艾美耳球虫鸡的饲料转化率得到了显著提高,而IL-1β、IL-8、IL-15、IFN-γ、TGFb4和淋巴细胞趋化因子则可降低球虫的复制。细胞因子的剂量和类型也会影响局部免疫反应的质量。研究表明,联合注射pcDNA3.1-IL-2重组质粒对鸡球虫疫苗免疫具有增效作用[25]。近年来,IL-2被证实可与多种艾美耳球虫抗原相结合,如TA4、SO7以及堆型艾美耳球虫抗原cSZ-2,表明IL-2的联合应用可增强基因重组疫苗诱导的免疫保护效果。
2.3 抗原多样性
了解球虫基因组遗传多样性的程度与研究其野外生存和进化能力高度相关。在外界选择压力的变化下,适应的速度对球虫的生存至关重要,常受到遗传多样性的影响。Emily等[26]对248条来源于堆型、巨型和柔嫩艾美耳球虫的ITS1-5.8S-ITS2序列的固定系数(FST)进行了比较,结果表明其存在显著的种内多样性,其中柔嫩艾美耳球虫可能存在地域差异。艾美耳球虫的遗传多样性和复杂的生命周期使基因重组疫苗的研制成为一项艰巨的任务[27]。
迄今为止,各界学者仅对少数艾美耳球虫的候选疫苗抗原进行了详细的序列分析以确定其多样性。研究发现,当巨型艾美耳球虫顶膜抗原EmAMA1作为DNA疫苗或细菌载体重组蛋白疫苗进行免疫时,可诱导强大的同源免疫保护作用[19]。此外,对来自中国、埃及、德国、印度、日本、利比亚、尼日利亚、英国、美国和委内瑞拉的56份柔嫩艾美耳球虫现场样本的EtAMA1编码序列分析显示,该样本存在中度多态性,与柔嫩艾美耳球虫的全基因组多样性形成鲜明对比[28],说明AMA1是一种良好的候选疫苗抗原。李灵娟[29]通过分析从毒害和堆型艾美耳球虫中克隆到的NA4和3-1E抗原基因,发现NA4抗原与柔嫩艾美耳球虫的TA4抗原之间基因序列的同源性达91.4%,氨基酸序列的同源性为86%;3-1E抗原在柔嫩艾美耳球虫和堆型艾美耳球虫之间的基因序列同源性达99.8%,氨基酸序列的同源性为99.4%,动物交叉免疫保护试验证明两种抗原对4种艾美耳球虫均有部分交叉免疫保护作用,说明这2种抗原有可能作为艾美耳球虫交叉免疫保护性DNA疫苗的候选抗原。
抗原多样性会影响针对顶复门原虫如恶性疟原虫的实验性疫苗的效力。由抗原多样性导致的免疫逃避在堆型、巨型、和缓以及柔嫩艾美耳球虫中均有发现。因此,详细了解编码候选疫苗抗原的基因多样性是选择最优候选疫苗抗原的关键。
3 影响免疫效果的因素
3.1 免疫途径
由于免疫途径不同,参与免疫应答的效应细胞也不同,可能会对疫苗的免疫保护效果造成一定影响。免疫途径的选择应考虑多方面的因素,如接种部位细胞呈递抗原的能力、细胞的转染效率、抗原基因的体内表达水平和宿主易感性等。基因重组疫苗的免疫途径主要有注射、口服、点眼滴鼻、喷雾、电穿孔和基因枪技术等。研究发现,核酸疫苗腿部肌肉注射的效果最优,且抗鸡球虫病指数最高[30],说明肌肉注射是一种简单有效的免疫途径。若以志贺氏菌、沙门氏菌、李斯特氏菌作为球虫基因重组疫苗的载体,可采用口服免疫、鼻内滴注或鼻腔喷雾等方法提高粘膜免疫应答,但存在一定局限性。
3.2 免疫剂量
免疫应答强度和免疫保护力与免疫剂量有关。周赛等[31]将柔嫩艾美耳球虫Mic4-N端蛋白在重组酵母中表达,与AbISCO©-100佐剂结合后进行动物试验,发现10 μg蛋白+50 μg佐剂组CD4+T、CD8+T淋巴细胞百分率显著升高,增重显著升高,肠道病变计分、粪便OPG值显著降低,证明免疫剂量是影响抗球虫效果的因素之一。赵胜杰[32]制备了针对多种艾美耳球虫的混合DNA疫苗,其中柔嫩艾美耳球虫的最佳免疫剂量为10 μg,而另外3种球虫的最佳免疫剂量均为25 μg,说明对于不同种的艾美耳球虫,疫苗的最佳免疫剂量也不相同。
3.3 免疫次数
由于基因重组疫苗在体内表达量低、持续时间长的特点,免疫次数对免疫效果有很大影响。李祥瑞等[33]将含有生长激素基因的质粒导入小鼠表皮细胞后,88%的被免小鼠产生了抗体,二次加强免疫后抗体水平明显提高。顾有方等[34]研究了GC02鸡球虫病疫苗的免疫保护效果。结果显示,二次免疫的效果最优,可有效控制鸡球虫病的发生,且能明显促进雏鸡的生长。说明在初次免疫后,再次或多次加强免疫,可有效提高体液免疫或细胞免疫应答水平。
4 展 望
近年来,随着公众对食品安全的重视以及病原耐药性的问题,疫苗已代替药物成为球虫病防控的流行趋势。相较于活卵囊疫苗,基因重组疫苗制作成本更低,可诱导机体产生高水平保护性免疫,已成为当前研究热点。不同发育阶段的球虫,其抗原组成与免疫原性也不同,因此,将不同球虫保护性抗原基因连接到表达载体中,构建多价多表位基因重组疫苗将是未来基因重组疫苗研究的趋势。此外,利用细胞因子构建免疫调节型基因重组疫苗可以提高抗原呈递效率,增强免疫效果,具有较好的应用前景。
动物医学论文范文 第7篇
题目:基层兽医猪病料常用采集操作技术
摘要:本文就基层兽医猪病料采集的原则进行了介绍,提出了不同病料常用的采集操作技术,希望能够为基层兽医提供参考以及借鉴,不断提高检测结果的准确性。
关键词:基层兽医;猪;病料;采集;原则;技术
基层兽医在日常对猪病诊断过程中,常常会遇到很难通过感官确诊或者定性的疾病,此时需要采取实验室诊断方法确诊。在实验室诊断前,首先需要采集病料,只有掌握猪病料采集技术要点,严格并且严谨的实施病料采集,才可保证疫病监测以及治疗工作的顺利开展。
1 病料采集的原则
1.1无菌采集。在病料采集过程中,必须保证全程无菌操作。尤其是需要进行血清学检查以及微生物检查的样本。所采用容器以及器械等必须经过严格的消毒处理,严格按照相关无菌操作规程进行操作。
1.2典型性。应保证所采集用于检疫的饲料具备代表性以及针对性。结合病害流行的特点明确需要采集病料的种类,在此基础上选择病料组织、分泌物以及排泄物等。
在此过程中需要注意,在选取动物过程中需要遵循典型性原则,保证所选择动物没有经过药物治疗,其临床症状具备代表性,在检查细菌性传染性疾病时尤为重要。
另外,选取病料时也需遵循典型性原则,尽可能选择病原体含量较高的病料。在准备采集病料前,首先需要对感染病害进行初步诊断,重点对常常受到病原体侵害的部位采集。
1.3适时性。应当准确把握病料的采集时间,尤其在夏季需要将采集时间控制在4h以内。如果采集时间过长,常常会导致病料组织发生腐烂现象,很难检测出原有病原组织。如果情况所需,应对早期发病的活体组织进行急宰并采集病料组织[1]。
1.4安全采集。在样本采集过程中,必须保证操作的安全性,在防止人员受到感染的同时避免因病原菌发生扩散而导致感染面积的增大。如果病猪为疑似炭疽病,不得立即为其剖检,而是需要切开其颈静脉处的皮肤,将少量血液抽出后制作压片以开展血片检查。
2 病料采集操作技术
2.1 采集前准备。
2.1.1 人员。在病料采集前,必须对采集人员开展相关业务培訓工作,保证其具备足够的生物安全意识。例如,如果病猪患有疑似非洲猪瘟疫情,采集人员在采集之前必须明确掌握非洲猪瘟传播、感染以及预防相关知识,同时能够对生猪进行熟练保定病采集病料。
2.1.2 物品。结合需要采集的病料制定一个科学合理的采集计划,同时做好所需物品的准备工作。通常情况下,需要为采集操作准备各种类型的手术器械、病料包装袋、容器以及消毒剂等。
对于在病料采集过程中需要使用的各种手术器械,必须提前在121℃下高压灭菌30min。对于注射器、采血针以及采血管等,需要使用一次性无菌制品;如果不具备一次性物品,必须再使用前落实无菌处理。对病料采集过程中需对70%的酒精、福尔马林固定液、保存液、其他消毒液等各种所需溶液进行配制。另外,还需提前准备防护服、防护口罩、无菌手套、病料采集单、记号笔、护目镜以及胶靴等。
2.1.3 环境。在采集病料之前,首先需要选择最为适宜的病料采集位置,同时对病料采集环境进行严格的消毒。严格处理各种废弃物,防止病毒传播扩散,避免发生污染。
在病料采集过程中所使用的手术刀片以及注射器针头等在使用完毕后需要立即置于封闭的锐器盒内,同时进行严格的无害化处理;对于一次性防护用品以及注射器等,则需置入密封袋无害化处理。
在病料采集工作结束后,需要及时采用消毒剂对动物尸体进行喷洒消毒,接着装入密封袋中无害处处理。采集人员需要更衣消毒,对环境进行有效的清洁以及彻底的消毒。
2.2 病料采集方法。采集人员需要严格按照相关操作规程开展病料采集工作。
2.2.1 血液采集。猪只不仅脂肪层较厚,同时具备较厚的肌肉层,通常情况下很难直接触及其血管,因而对其采集血液难度较大。在临床上,血液采集方法较多,但是要想在获取大量血液的同时使采血速度得到保障,通常采用颈静脉采血方式以及前腔静脉采血方式。可以结合猪只大小等各种客观因素灵活选择适宜的采血方法[2]。
(1)颈静脉采血。对猪只进行站立式保定,保证被保定猪只头部处于垂直上举状态,同时身体与头部垂直不存在扭曲现象。操作人员需要从猪只颈静脉沟处将针刺入,对着微偏中心线背部方向抽取血液。
(2)前腔静脉。与颈静脉采血方式采取同样的保定方法。在保定好后,猪只颈根部以及胸骨之间会出现一个凹陷窝。在采血过程中,将针头对着凹陷窝的位置刺入,刺入方向为一侧肩胛骨顶端方向。另外,病猪机体左侧内,心脏以及膈肌内存在着较多的迷走神经,但是其右侧较少。在扎针过程中,一旦碰到迷走神经,常常会导致猪只出现抽搐以及呼吸困难等各种症状。因而,在采血过程中在凹陷窝位置入针以后将插针方向控制在向右肩胛骨方向。
(3)血液处理方法。在病原学检测过程中,需要采用具备抗凝功能的血液。在采集过程中,所采用真空采血管内应当已经加入了枸橼酸钠、EDTA或者肝素等各种抗凝剂,或者抽取果抗凝剂浸润过的注射器。严禁对所采集血液进行冷冻保存,将其保存温度控制在2-10℃,严格控制保存时间,不得超过24h。如果保存时间过长,红细胞极容易发生变形或者破裂,使显微镜的观察受到影响。
如果需要进行血清学检测,在检测之前首先需要制备血清。通常情况下通过离心分离来制备血清,在离心之前,需要将血液保存于温度为4℃的冰箱内2h,以促进血清的析出[3]。离心过程中,将离心机的转速控制在2000r/min,离心时间控制在10min。另外,也可以将血液在采血管内自然放置12-24h从而将血清析出。可以采用冷冻方式对血清进行保存,但是冷冻保存方式保存时间不宜超过7天。在此过程中需要注意,反复冻融会导致血清内物质的活性遭到破坏,使评价工作受到影响。
2.2.2 组织采集方法。在组织病料采集过程中,需要遵循无菌操作,保证一畜一套器械。在采集心脏、淋巴结、肾脏以及脾脏等病变脏器组织时,必须保证操作迅速,尤其是在气温较高的夏季,需要将采集时间控制在4h内,如果采集时间过长,组织器官常常会发生自溶、腐败以及变性等各种情况,使检验效果受到影响。在活体病料采集过程中,如果为多只动物发病,首先对存在明显症状的猪只采集。需要将所采集病料置于50%的甘油缓冲液内保存并送检。如果需要开展病理组织学检查,需要将所采集组织置于95%的酒精中或者福尔马林溶液当中。固定组织以及固定液的体积比为1:10,通常在固定后24h需要对固定液进行1次更换。对待送检病料进行编号,同时做好其记录工作。妥善包装送检病料,例如组织病料以及血液需要冷藏保存,而病理学材料不得冰冻。
2.2.3 尿液。在猪只排尿过程中,采取一次性塑料杯接取其尿液。
2.2.4 粪便。采用无菌棉拭子从猪只直肠内或者肛门内壁部位沾取新鲜的粪便,接着将棉拭子置于密封袋内,在此过程中折断并舍弃手拿捏棉拭子柄的位置,以防所采集粪便受到污染[4]。
2.2.5 鼻分泌物。采用无菌棉拭子沾取猪只鼻腔内或者鼻镜内的黏液。接着采用与粪便采集同样的方式将其置于密封袋内。
2.2.6 皮肤。采用锋利的外科刀具从病变皮肤部位刮取皮屑、结痂以及毛发等并置于容器内。
2.2.7 乳汁。采用消毒液对乳房、乳房附近毛发进行消毒。弃取最初几股乳汁,接着采集10-20ml乳汁并置于灭菌容器当中。
参考文献
[1] 陈峰, 党安坤, 徐淑华, 等. 猪的病料采集方法和注意事项[J]. 现代畜牧科技, 2019, (8): 15-16.
[2] 伊军. 基层兽医病料采集的要点分析[J]. 畜牧与饲料科学, 2016, 37(5): 111-112.
[3] 姚奕蕾. 基层兽医之言是样品采集、工作中必须注意的问题与建议[J]. 国外畜牧学—猪与禽, 2016, 36(5): 93-95.
[4] 尕吉. 动物检疫中病料采集的原则及常用的方法[J]. 中国畜牧兽医文摘, 2016, 32(6): 103.
动物医学论文范文 第8篇
题目:奶牛乳房炎诊断方法研究进展
乳制品已成为人民日常生活不可或缺的主要食品,其产业发展与奶牛养殖业密不可分。奶牛乳房炎(bovine mastitis,BM)是严重危害奶牛养殖业的重要疾病之一[1],其诊断技术水平直接反映国家畜牧业发展水平和科技实力。本文主要论述了不同诊断方法的优缺点,并思考了如何将诊断技术更好地应用于实际生产中,以期为防治该病和开发诊断新技术提供参考。
1 奶牛乳房炎概况
1.1 流行现状及危害
奶牛乳房炎又称奶牛乳腺炎,是乳腺受到物理、化学、致病微生物以及其他因素所引起的一种炎性变化,主要表现为乳汁理化性质改变、体细胞数变化以及乳腺组织病理学变化。据报道,全世界每年因乳房炎经济损失达350亿美元,仅美国奶业损失每年可达20多亿美元,在我国奶牛乳房炎发病率约为46%~70%[2]。其危害主要体现在以下几方面:(1)可致泌乳量降低10%~15%及乳质量变差,治疗不当可致终身不产乳[3]。(2)影响繁殖性能且导致奶牛淘汰率达9%~10%[4]。(3)病牛乳汁含有非乳源性杂质或治疗的抗生素等药物残留,影响食品安全。
1.2 分类及发病机制
根据乳汁肉眼可见变化,可分为临床型乳房炎(clinical mastitis,CM)、隐性乳房炎(subclinical mastitis,SM)和慢性乳房炎。根据发病特点和病理变化又分为浆液性乳房炎、卡他性乳房炎、纤维蛋性乳房炎、出血性乳房炎、化脓性乳房炎、坏疸性乳房炎。
乳房炎发生主要包括3个时期[5]:(1)因各种不良因素,致使病原菌从乳头口入侵乳头管;(2)病原菌侵入乳腺组织后,在乳房内繁殖进而导致重复感染;(3)乳腺组织发生炎症反应。
2 奶牛乳房炎诊断技术
2.1 病原菌分离
病原菌分离常被认为是传统诊断的“金标准”,分离培养出的病原菌对于抗生素选择使用有许多优势。但该方法对隐性乳房炎鉴定准确性低、耗时长、变异性较大,易出现假阴性。
2.2 体细胞计数法
体细胞计数法有直接和间接计数法两种。直接计数法主要用仪器进行测定,如利拉伐细胞计数器、Fossomatic 细胞计数器等简单准确,可自动地分析大量样本。但花费高,使用不普遍。
间接计数法主要是破坏乳汁中体细胞,使其释放核酸物质,进一步反应会产生沉淀或凝胶。研究表明,乳汁体细胞数低于2×105个/mL为阴性,在2×105个/mL~5×105个/mL之间为可疑,大于或等于5×105个/mL则判定为隐性乳房炎[6]。基于此原理,常用的有美国加州乳房炎诊断试剂(CMT),但其准确度(87.4%~90.8%)较低。在我国也有兰州(LMT)、北京(BMT)和杭州(HMT)等诊断试剂。该方法较为费力且不适合初乳期和泌乳后期,在大型奶牛场中可作为辅助诊断。
2.3 分子生物学诊断
分子生物学技术包括聚合酶链式反应(PCR)、环介导的等温扩增(LAMP)和多重实时PCR等,可检测引起亚临床乳房炎的病原体或其遗传物质。PCR一般以16S~23S rRNA间隔保守区为扩增序列。希尼尼根等[7]建立了可同时检测金黄色葡萄球菌、大肠埃希氏菌、牛支原体的多重PCR方法,该方法敏感性分别为10 pg/μL、1 pg/μL和10 pg/μL。
LAMP具有钙黄绿素介导的量热无线检测系统,可在65 min内有效检测病原体,更适用于金黄色葡萄球菌快速检测[8]。Kawai等[9]选择引起乳房炎的12个属的病原微生物,利用32个引物以及能同时检测所有病原的DNA芯片,通过LAMP优化DNA扩增条件,与细菌培养结果相比,当培养法设置为100%时,DNA芯片的总阳性率为85.0%,总阴性率为86.9%,此方法可快速准确检测到乳房炎的病原。
多重实时荧光定量PCR是传统PCR的改进,利用荧光信号积累对扩增的DNA进行实时监测。张莉莉等[10]针对大肠埃希氏菌、无乳链球菌和金黄色葡萄球菌的保守序列设计合成了3套特异性引物,通过优化PCR反应体系和反应条件,建立的多重TaqMan荧光定量PCR检测方法,最低检测浓度分别为102、103、104拷贝数/μL,敏感性较高,DNA各个拷贝数浓度变异系数均低于2.02%,重复性良好,具有良好的推广应用价值。与传统培养方法相比,PCR诊断技术特异性强、敏感性高、操作方便、耗时短且误差小。
2.4 生物物理技术诊断
电离飞行时间质谱(MALDI-TOFMS)、傅里叶变换红外光谱(FTIR)和红外热成像(IRT)均能显著促进乳腺炎相关病原菌的鉴定,允许从物种水平对细菌进行准确鉴定。Magro等[11]研究,基于质谱原理的MALDI-TOFMS可在极短时间内测定细菌种类或其蛋白质。该技术特异性强和灵敏度高,能替代或补充通过表型方法进行鉴定,但仅适用于现有细菌蛋白质谱的特定光谱数据库,如广泛使用不太经济。
傅里叶变换红外光谱(FTIR)技术基于对全生物体DNA鉴定,通过被测物种的光谱与参考数据库中已知物种的光谱进行比对,可在亚种或品系水平上区分乳房炎病原体生物,分别使用FTIR和MALDI-TOF MS方法鉴定牛乳腺炎相关的革兰氏阳性、过氧化氢酶阴性球菌,其正确率分别为100%和90.5%,前者略优于质谱法[12-13]。
红外热成像(IRT)基于皮肤或乳房表面的热或温差,以图像形式反映。其高灵敏度热感相机可检测乳房表面温度的微小变化或炎症,通过移动信息技术应用,可以成为一个便携式诊断工具[14],其敏感性和特异性分别为95.6%和93.6%[15]。其敏感性和特异性虽然很高,但在实际操作中难度大,有待进一步研究。
2.5 基于传感器的乳房炎诊断
在诊断领域,监测奶牛乳房炎发病时或发病前行为变化极其重要。奶牛在采食量和整体活动方面变化显著,这些疾病迹象在临床症状出现前几天就很明显,因此可作为监测指标。Chinnappan等[16]基于磁性纳米颗粒,通过使用纤溶酶的蛋白水解活性作为生物标记,开发了一种特异性检测金黄色葡萄球菌和其他葡萄球菌的比色生物传感器,其灵敏度在体外测定为1 ng/mL纤溶酶。该方法能区分健康乳和病乳,且在乳房炎诊断过程中反应迅速、简单、灵敏、潜力大,可用作初始诊断。
2.6 蛋白质组学分析
蛋白质组学方法在诊断、预测和预防奶牛乳房炎以及标准化质量方面非常有用。这种方法有助于鉴定乳房内感染(IMI)生物标志物[17-19]。研究表明,N-乙酰-β-D-氨基葡萄糖苷酶(NAGase)就是一种重要的BM炎症标志物,基于此可对全乳复杂基质进行分析[20]。一些组合策略液已被用于奶牛乳房炎期间牛奶的蛋白质组分析,如双向凝胶电泳后的MALDI-TOFMS(2D-GE),液相色谱和串联质谱的联合应用。Abdelmegid等[17]采用二维差异凝胶电泳(2D-DIGE )结合液相色谱和串联质谱技术,从具有肥大症状的病乳中检测到28种高丰度蛋白,其中9种具有宿主防御功能,这些蛋白包括参与先天免疫和抗菌功能的急性期蛋白以及与病原体免疫反应相关的蛋白,可成为奶牛隐性乳房炎潜在的候选生物标志物。
2.7 特异性免疫分析
根据抗原抗体反应特性,免疫检测成为诊断亚临床乳腺炎的有效方法,如乳胶凝集法、免疫层析法[21]。Jaeger等[22]利用牛乳淀粉样蛋白A作为检测亚临床乳房炎的生物标志物,通过酶联免疫吸附试验(ELISA)进行了检测,其结果对主要病原体检测灵敏度为81.4%、特异性为93.4%,对全病原体检测灵敏度为88.0%、特异性为65.2%。与常规酶联免疫吸附试验相比,基于磁珠的酶联免疫吸附试验具有快速、操作简单、检测试剂少的优势。但可能存在由于交叉反应导致非特异性高缺点。此外,成本较高,对基础设施和人员技术熟练的要求高。
2.8 基因测序分析
基因分型、指纹识别已经成为一种重要的奶牛乳房炎诊断工具,不仅用于微生物的种、亚种、菌株水平鉴定,还用于流行病学研究。核糖分型、脉冲场凝胶电泳(PFGE),扩增片段长度多态性(AFLP)、随机扩增多态DNA(RAPD)和多位点序列分型(MLST)经常被用于基因分型[23,24]。Pumipuntu等[25]使用PFGE和MLST进行金黄色葡萄球菌引起牛乳房炎的各菌株基因分型鉴定,发现凝固酶阳性分离株具有11 种不同的PFGE模式和一种不可分型模式,其中个别模式与多位点ST无关,在金黄色葡萄球菌中发现了3个新的ST隔离。陈婷婷等[26]利用多位点序列分型(MLST)对甘肃部分地区奶牛乳房炎金黄色葡萄球菌进行了检测,发现26株金黄色葡萄球菌中存在9种ST序列型,其中ST59为优势序列型。本方法具有方便、准确的特点,但因其成本昂贵、耗时长,现阶段难以投入临床使用。
3 奶牛乳房炎诊断在防治中应用的思考
3.1 早期快速准确诊断是做好防治工作的重要前提
奶牛乳房炎因素多,涉及病原广,以分子生物学及免疫学技术为基础,开发现场快速及实验室高通量快速准确诊断技术将是未来发展趋势,如多病原基因芯片或蛋白芯片技术,基因组、蛋白质组及代谢组学技术。此外,智能化、信息化技术结合也是诊断领域研发热点,如生物传感器技术有望成为检测奶牛乳腺炎的重要工具。各方法优缺点不同,单一应用无法达到理想目标。因此,多种方法联合应用可更准确的防治,如以PCR检测为主,体细胞计数法检测相结合的应用。
3.2 特征性生理指标及代谢产物等检测技术开发是做好防治工作的重要支撑
隐性乳房炎系诊断领域重要课题。及时监测奶牛采食量及整体活动方面的变化,如用IRT技术监测奶牛乳房表面温度,再通过检测乳汁中一些酶活性物质的活性或代谢产生的微量元素来客观评估乳房炎的病程情况,为实施综合治疗方案提供支撑。
3.3 简便、快捷的适用技术广泛推广是临床诊断的迫切要求
不同规模的养殖场应采取相适应的检测技术,在大型规模化养殖场中,奶牛数量多,若用常规检测,则费时费力,贻误病情。应利用数字化、信息化、人工智能等相关技术使用传感器数据来改善乳房炎管理的新方法。在小型养殖场中,饲养及相关兽医技术人员层次不齐,开发类似乳汁电导率检测、乳汁pH测定、乳清中蛋白含量测定以及现场荧光定量PCR、试纸条、LAMP等简便、适用技术,是进行快速推广和实现及时快速处置的有效手段。
动物医学论文范文 第9篇
题目:绵羊短尾表型研究进展
世界上脊椎动物的尾巴大部分是天生的,尾巴被赋予了独特的功能,如维持身体平衡、同一物种间的通讯工具和攻击、储存营养、运动、体温调节等[1],研究人员发现一类动物的尾部长度明显短于此范围,这种现象可以稳定地遗传给后代,“短尾征”也以此现象命名[2]。在进化过程中,犬、猫、鼠、猴等动物也出现了尾巴缺失或缩短的情况。绵羊也不例外,国内外研究者因此提出了绵羊“短尾征”的概念。目前,动物短尾的成因已成为动物遗传学的重要研究内容之一。然而,国际权威网站上关于“短尾征”的研究论文主要集中在犬、猫、小鼠的短尾形成方面,绵羊短尾机制的研究较少。
中国地方绵羊品种按尾型分为5种,即短肥尾羊、长肥尾羊、短瘦尾羊、长瘦尾羊、肥臀羊。根据历史、考古和遗传学证据,蒙古羊是中国短尾羊品种的共同祖先。随着对健康、营养和肥胖认识的不断提高,人们对肉类食品质量的要求逐渐提高,脂肪含量已成为衡量肉类食品质量的主要因素,脂肪的过度积累将严重影响动物的健康和肉类食品的品质和口感,因此高蛋白羊肉在畜牧产品市场越来越受消费者的欢迎。因此,综合考虑消费者健康及牧民的养殖效益,养殖短尾羊已经成为养殖业的新选择。在众多短尾绵羊品种中,呼伦贝尔短尾绵羊因其高蛋白质含量、独特的肉质、高瘦肉率和遗传稳定而脱颖而出。呼伦贝尔羊有2个品种,即“短尾羊”和“大尾羊”。由于不同绵羊尾部性状存在诸多差异,造成此差异的遗传学机制还不明确,因此研究控制绵羊尾部表型的形成机制至关重要。论文在绵羊短尾性状遗传学机制研究上做一综述,以期对了解和研究控制绵羊尾部大小的分子机制提供理论基础。
1 绵羊尾部及短尾表型形成机制研究
研究人员发现,绵羊短尾表型的形成主要是由于尾部脂肪沉积和尾椎骨畸形[3]。目前,蒙古羊是中国分布最广、数量最多的绵羊品种。随着贸易、民族间战争和草原部落向南移动,除了内蒙古自治区外,蒙古羊被传入中国新疆、甘肃、青海、河南、山东、江苏、浙江等省份,是我国宝贵的畜牧遗传资源之一。目前,由于消费者对肉类的低脂肪、高蛋白、高营养等健康食品的要求,越来越多的牧民正在繁殖和扩大绵羊中的短尾型绵羊的养殖。这使得绵羊短尾表型形成机制成为了众多科研人员研究的热点问题。对于尾部脂肪沉积与尾椎骨畸形两方面的研究内容,不同的研究人员得出了不同的研究结论,但是,现阶段大部分相关研究更多的聚焦于某一种引起短尾性状的生物分子学机制,这可能与不同类短尾表型绵羊所在地域和人工繁育以及研究时所选参考基因组版本等诸多因素密切相关。现有研究显示,虽然不同地区短尾绵羊在表型上有一定的差异,但绝大部分表型是脂尾短厚而宽,部分覆盖或完全露出肛门、外阴。
1.1 影响短尾绵羊尾部脂肪沉积的因素探讨
储存在羊尾巴上的脂肪与储存在骆驼驼峰上的脂肪起着相同的作用,帮助它们在环境恶劣、食物资源匮乏的不利环境中生存。在食物充足的情况下,肥尾羊会在尾部储存大量多余脂肪,形成一条又长又大的肥尾巴。由于绵羊脂肪的积累需要摄取更多的能量,所以会降低绵羊的经济价值。发展和繁殖短尾型绵羊的目的是为了提高绵羊饲养过程中的肉类比例,满足消费者对健康食品的需求。早期的研究表明,影响绵羊尾巴沉积的基因不会影响绵羊的整体脂肪水平,而只影响身体某些部位的脂肪沉积[4]。一些研究人员直接以绵羊的尾巴为研究对象,筛选和鉴定与尾巴脂肪积累相关的基因。
1.1.1 基因 文献[4]选择湖羊(短肥尾)和藏羊(短瘦尾)作为研究对象,该研究指出,绵羊尾巴中的脂肪沉积和绵羊尾巴长度的类型可能与BMP2蛋白有关。另外,Bmp2基因直接参与了绵羊胚胎时期的形态和体节的发育[5]。Bmp2基因与非洲爪蟾尾巴的再生和发育有关,这一点在非洲爪蟾的研究中也得到了证实,并且Bmp2基因作为转录抑制剂直接受Vrtn基因调控。Vrtn基因也是控制绵羊和猪脊椎动物数量的主要候选基因。综合来看,Bmp2基因可能在动物骨骼发育过程中起作用。与大尾羊相比,短尾羊的尾骨数量与脂肪量明显较少,但Bmp2促进脂肪的形成和成骨细胞的分化,调节绵羊尾骨数量或直接参与绵羊尾巴脂肪的积累,影响脂肪积累量[6]。该项研究推测得出尾椎体数量的增加与脂肪沉积量的增加有密切的关系。
1.1.2 蛋白 在蛋白质组学的研究方面,有研究成果表明FABP4蛋白在尾部沉积中起着重要作用[7],PPAR信号通路中的差异表达蛋白可能调节脂肪细胞的代谢和分化。参与PPAR信号通路的差异表达蛋白可能发挥了对绵羊尾臀部脂肪细胞的分化与脂质代谢的调节作用,特别是肥尾型绵羊的FABP4蛋白的高表达。Han J等的研究筛选得到了大尾羊中有几种与脂肪沉积和脂肪形成相关的功能候选基因包括acsl1、acaca、acly、fasn、atgl和hsl,这些基因已被验证为决定脂肪组织脂质代谢的重要因素[7]。同时,该项研究检测到acsl1、acaca、acly和fasn这4种基因分别在大尾绵羊尾部中上调,这些上调的蛋白质可能在调节脂肪酸的运输、合成和脂肪组织的形成方面起重要作用[8,9]。脂肪细胞的生长和分化导致脂肪细胞的质量增加和脂肪的积累,都是产生脂肪的主要原因[10]。PPAR信号通路对调节脂肪细胞分化和脂肪细胞增殖起着重要作用[11],PPAR信号通路中的基因(包括Fabp4、Fabp5、Acaa1、Acsl1、Lpl、Acsl6、Plin4、Plin1、Scd和Adipoq)在大尾羊尾部基因表达明显上调。PPAR信号通路中这些上调的基因可能有助于绵羊尾部或臀部的脂肪沉积[12]。
在Ren X[13]等使用了SNP基因分型技术的研究中,发现4个候选基因(Rip140、Ctbp1、Steap4和Creb1)可能与绵羊尾部脂肪沉积相关。Hongying Fan[14]等人以呼伦贝尔短尾羊与巴尔虎羊(大尾羊)为研究对象,并进行转录组测序发现Hadnb、Echs1、Acsl5、Hadh和Ppt1这5个基因表达上调,Cpt1b和Gcdh2个基因表达下调,通过对短尾母羊与大尾母羊的数据分析发现大尾羊尾巴中有7个基因(Fads1、Fads2、Acsl1、Elovl5、Plin1、Ehhadh和Acald)上调,这解释了呼伦贝尔短尾羊和巴尔虎羊尾脂肪相关基因的差异表达。
Zhang等[15]对细尾羊和肥尾羊品种的研究中,染色体5、7和X被确定为影响脂肪沉积的3个基因组区域。Moioli等[16]对2个肥尾品种和13个细尾品种数量的标记基因全谱检测发现,基因Bmp2和Vrtn可能与羊尾型有关。Yuan等[17]在肥尾和细尾羊中检测到标记基因Bmp2、Hoxa11、Wdr92、Ppp1cc、Sp3、Sp9和Prokr1对肥尾羊和细尾羊的尾部脂肪发育有积极影响,并可通过相关基因的表达促进脂肪分解。对蒙古绵羊尾部脂肪沉积的研究表明,发育基因Hoxc13、Hoxc12、Hoxc11和脂肪尾部表达基因Sp9、Hotair3、Hotair2以及脂肪相关基因Adipoq、Cd36、Fabp4、Fabp5都是形成脂肪沉积的重要基因[18]。
1.1.3 微小核糖核酸miRNA 微小核糖核酸(microRNA,miRNA)是一种非编码的单链RNA分子,由内源性基因编码,长度约为22个核苷酸。它是由Dicer和Drosha核糖核酸酶Ⅲ蛋白质处理的茎环结构。miRNA在脂肪细胞分化和维持生物稳态中起着决定性作用。Mohammad[19]等以Lori-Bakhtiari羊(宽肥尾)和Zel羊(瘦脂尾)为研究对象,最终筛选出7个不同表达的基因,发现了3个重要的生物过程模块与胰岛素分泌、脂质代谢有关。近年来,关于miRNA在生物体内家畜脂肪组织中的作用的研究越来越多,但关于绵羊miRNA的脂质控制代谢的报道很少。徐红伟[20]等发现,从形态学和组织学的角度,以小尾寒羊和兰州大尾寒羊为实验对象,对尾脂进行组学分析,筛选出不同表达的蛋白质、基因和非编码RNA(ncRNA)等调控因子,这对了解不同肥尾类型绵羊体脂分布的机理具有重要作用;在小尾寒羊和兰州大尾巴羊的尾部脂肪组织中,共发现了11种miRNA表达的差异性,其中6种miRNA在不同的脂肪组织中表现的差异特别明显。显然,仅通过基因表达谱分析很难准确地找到脂肪沉积的特定调控途径。有必要在现有基础上进行深入研究,以揭示羊尾脂肪沉积的确切遗传机制。
1.1.4 性别因素 性别差异引起二者在新陈代谢上表现出极为显著的差异,过往研究分析了大量性别差异下的生理学异同,比如,差异化性别间的激素水平与基因表达的不同之处,研究结果显示,相对于男性腹部,女性臀部与大腿部分的脂肪沉积更明显。这说明,某些特定部分的脂肪沉积受到独特基因的控制。所以,在特定部位与不同性别间脂肪沉积的遗传机制是存在差异的。Hongying Fan[21]对比研究了呼伦贝尔短尾羊和大尾羊2类呼伦贝尔羊的尾部转录组测序结果,其创新之处体现在将性别影响因素考虑进来展开研究,在尾部大小一致的两种性别间对比,结果显示,大尾羊和小尾羊分别有独立的9个和12个生物学过程。首先,在尾部大小不一样的雄性绵羊群中,在13条KEGG信号通路内富集差异基因。在其中确定了与脂肪酸代谢存在相关性的脂肪酸降解、脂肪酸代谢和延伸率三个生物学过程。在尾部大小不一样的雌性绵羊群中所获得的差异基因,合计富集到51条KEGG信号通路,而与脂肪沉积存在相关性的信号通路有两条,参与了脂肪酸代谢和脂肪细胞中脂质降解的调控过程。然而,在短尾羊样本内与脂肪代谢相关的信号通路仅有PI3K-Akt信号传导途径这一条。在对比大尾羊和短尾公羊的差异基因富集的信号通路时发现了与过氧化物酶体增殖物激活受体γ(PPARG)相关的信号通路。此项研究确定了7个基因影响PPARG及大量其他调节因子,进而对雄性呼伦贝尔绵羊尾脂肪中与脂肪酸代谢存在相关性的基因表达变化进行了解释,其中PPT1、HADH、ECHS1、HADHB和ACSL5这5个基因被上调,而CPT1B和GCDH基因则被下调。通过对比分析大尾与短尾母羊的相关数据可知,前者尾部的FADS1、ACADL、FADS2、PLIN1、ELOVL5、ACSL1和EHHADH基因表达都有上调,这7个基因可能影响绵羊胰岛素的分泌,并且也能够对巴尔虎羊与呼伦贝尔短尾羊尾脂肪中与脂肪酸代谢存在相关性的基因的差异表达进行了解释。
1.2 影响短尾绵羊尾椎骨发育的因素探讨
1.2.1Brachyury基因Brachyury基因(T基因)编码属于T-box转录因子家族的BRACHYURY蛋白。BRACHYURY蛋白的转录活性在中胚层的形成和分化中起着关键作用[22]。Brachyury/T基因首先在原肠期表达,随后的表达逐渐局限于发育中的尾芽和脊索,Brachyury/T基因的缺失或不正确表达将导致狗、猫、小鼠和绵羊的正常胚胎发育异常[23]。Brachyury/T基因在脊椎动物发育过程中可调控转化生长因子和Wnt信号通路,Brachyury/T基因在突变杂合子个体中显示骨缺损,在突变纯合子个体中显示严重的发育障碍,最终导致发育停止和死亡[24]。在对伊朗Dalagh短尾羊和Mehraban羊的研究中,提到纯合Brachyury/T突变仅表明这些羊的尾部脊椎发育受到抑制[25],这表明Brachyury/T突变可能促进大尾羊尾部脂肪的积累。
在J Han[26]等的研究中,特别强调羊尾巴表型与Brachyury/T基因的c.333G与c.G334T 的2个突变有关。对于Brachyury/T中的这2个突变位点,纯合基因型为CT/CT,仅存在于短尾绵羊中,但在大尾绵羊中未发现该基因型。Pfam结构域分析表明,333和334个核苷酸分别对应于111和112个氨基酸残基,短臂蛋白的T盒结构域可以激活基因转录。进一步的杂交试验表明,短尾羊和大尾羊后代Brachyury/T基因的333与334为杂合GG/CT突变,均为长尾或正常表型。结果表明,GG单倍型为单显性基因遗传,CT/CT可能为“短尾”表型的隐性基因型。仅通过对Brachyury/T基因表达的分析,很难了解尾椎体畸形的具体调控途径。有必要在现有研究的基础上进一步研究,以揭示绵羊尾部脂肪沉积的确切遗传机制。
1.2.2 其他基因 MGI数据库内记载了与短尾表型存在相关性的多种基因。对于小鼠身上导致短或异常尾巴的一系列不同基因可被视为是绵阳等其他短尾动物的候选基因。在关于鼠的研究中,从遗传学维度分析了轴向骨骼发育,研究结果显示,大量不同类基因与突变参与了尾椎骨的发育,并影响到机体的生殖力、体细胞与减数分裂,进而清晰地揭示了脊椎动物的进化过程[27]。
Pax1基因(成对框基因1)主要参与了骨骼发育和转录调控过程。在脊柱动物胚胎阶段脊柱发育过程中发挥着关键性的作用[28]。Pax1在小鼠中3个等位基因突变导致出现短尾或无尾现象,Pax1基因参与生骨节凝聚过程,且腰骶椎周围并未发生内侧生骨节的凝聚过程,因为不能正常无成此地程,使椎体与椎间盘无法正常生成[29]。
Wnt3a基因是Wnt家族中的一个成员,其对胚胎期神经后轴的增殖与体节发育都不可或缺[30]。去除此基因的小鼠,由于尾芽不能正常发育使得其身形变短,纯合突变的小鼠尾部大幅变形,表现出短尾、丝状尾和无尾等现象,尾椎骨不完整,椎体外形不正常。一些小鼠甚至缺少骶骨前椎体,并在这些部位可观察到畸形的尾部神经管。
再者,还有HES7基因[31]、Bmper[32]、Dvl2[33]和T基因[34]等。但是,考虑到动物的尾部形态类型多样,只是研究鼠这一种动物,是不可能下结论解释其他哺乳动物尾巴的多样性。所以,需要进一步研究非模型物种,深入全面地研究绵羊等非鼠类哺乳动物尾巴的多样性机制。
2 展望
绵羊尾部脂肪堆积过多,尾部过大,无法满足目前人们对优质肉类的需求。绵羊尾巴脂肪积累和绵羊尾骨发育畸形的遗传调节机制对绵羊新品种的选择具有重要意义。论文从影响短尾绵羊尾部脂肪沉积的因素、影响短尾绵羊尾椎骨发育的因素深入探讨绵羊短尾表型形成机制,综述了基因、蛋白、miRNA和性别对绵羊尾部脂肪沉积的影响以及Brachyury基因和其他基因对短尾绵羊尾椎骨发育的影响。通过总结国内外绵羊短尾表型形成机制的研究现状,关于绵羊短尾表型形成机制未来优化研究提出若干展望。后续研究中可精准筛选与绵羊尾部脂肪堆积和尾椎骨畸形过程相关的基因,探索绵羊尾部表型的调节机制,对分析绵羊尾部表型的形成具有重要价值,培育短尾和低脂肉用绵羊具有重要的意义。
动物医学论文范文 第10篇
题目:鸭疫里默氏菌毒力相关因子研究进展
鸭疫里默氏菌(Riemerellaanatipestifer,RA)可感染雏鸭、雏火鸡、鹅等多种禽类,引发高致病性、接触性传染病。本病最早于1932年发现于美国纽约州的长岛,其后在英国、加拿大、前苏联、澳大利亚等国亦有发生。我国于1982年首次报道有该病的存在。鸭疫里默氏菌病也称鸭传染性浆膜炎(Infectious serocitis,IS),该病主要感染1周龄~8周龄,尤其是2周龄~3周龄的雏鸭,引起多发性、渗出性炎症和全身性败血症。病变主要以纤维素性心包炎、肝周炎和气囊炎为特征。鸭疫里默氏菌病发病率可达90%以上,病死率高达75%。目前,该病在世界范围内广泛流行,是危害养鸭业最为严重的细菌性传染病之一,给养鸭业造成巨大经济损失。
鸭疫里默氏菌为革兰氏阴性菌,其菌体细胞壁表面多糖抗原具有多样性使得该菌的血清型呈多态化。目前确定的鸭疫里默氏菌有20多种血清型,且不同地区流行的血清型存在较大差异。血清1型、2型、10型菌株是近年来国内的优势流行菌株。不同血清型之间缺乏交叉免疫保护性,生产中多见多种血清型混合感染且新血清型不断出现的情况,给该病的防控造成很大困难。
病原菌致病是细菌与宿主复杂相互作用的结果。一方面细菌通过表达、分泌多种毒力因子入侵宿主、逃避宿主免疫系统的捕杀并完成在宿主内的繁殖,另一方面宿主通过其防御系统抵抗这些毒力因子的作用。为有效防治鸭疫里默氏菌病,需要深入研究该菌感染的分子机制和毒力因子。近年来,随着研究的深入,越来越多的RA毒力相关因子被发现和报道[1]。
1 细菌外膜相关组分
1.1 外膜蛋白
外膜蛋白(outer membrane proteins,OMPs)是革兰氏阴性菌外膜的主要结构成分,位于病原菌表面,也是最先与宿主细胞相互作用的部位,在维持菌体自身结构及物质转运、致病等方面发挥着重要作用。OMPs还具有较强的免疫原性且能诱导保护性免疫反应[2]。非菌毛黏附素——外膜蛋白A(OmpA)是一种多结构域蛋白,存在于大多数革兰氏阴性菌的外膜中。OmpA蛋白是鸭疫里默氏菌中最早被鉴定的、具有免疫原性的主要外膜蛋白[2]。研究发现,RA野生株Th4的OmpA基因缺失株Th4ΔompA对Vero细胞的黏附入侵能力显著低于野生株,且Th4ΔompA对10日龄樱桃谷鸭的致死力较野生株下降了10倍以上[3]。表明OmpA是RA的一个重要毒力因子。
1.2 表面多糖
1.2.1 脂多糖生物合成相关因子 细菌脂多糖(lipopolysaccharide,LPS)又称内毒素,是革兰氏阴性菌胞壁特有的组分。在感染过程中,LPS可激活炎性细胞释放多种炎症因子,导致多种生理和病理损伤。LPS由3种不同的成分组成,即脂质A、O抗原和核心寡糖。研究发现,RA Yb2株AS87-04050基因编码LPS。通过转座子插入诱变技术使AS87-04050基因失活,银染鉴定突变株RA2640的LPS形态与野生株不同,在形态结构上由光滑型变为粗糙型;RA2640较野生株对抗生素、消毒剂和正常鸭血清的敏感性更高,且RA2640的毒力降低了10万倍以上。表明RA AS87-04050基因与RA LPS的生物合成有关,并影响RA的致病性和毒力[4]。
研究者通过构建RA Tn4351转座子突变文库,分别筛选到RA CH3菌株M949-1360、M949-RS01035、M949-RS01915基因的缺失突变株RAΔ604、RA1062、RA1067。突变株RAΔ604不能产生LPS,对Vero细胞的黏附入侵能力较野生株下降,且对鸭的半数致死量(median lethal dose,LD50)比野生株高了200倍[5]。突变株RA1062与抗CH3 LPS单克隆抗体作用无反应,LPS表型较CH3野生株粗糙,且对补体依赖性杀伤的敏感性更高,血液细菌载量降低,毒力减弱[6]。M949-RS01915基因参与RA LPS O抗原的合成,其基因缺失突变株RA1067的LPS与野生株相比存在缺陷;RA1067生长较野生株慢,对补体系统更加敏感,对Vero细胞的黏附和侵袭能力均下降,感染鸭血液中菌量也明显降低,毒力下降了360多倍[7]。以上结果表明RA CH3菌株的M949-RS01915、M949-1360、M949-RS01035基因也与RA LPS的生物合成和RA的毒力有关。
1.2.2 荚膜多糖生物合成相关因子 荚膜多糖(capsular polysaccharide,CPS)是位于细菌最外面的一层厚度不定的黏液物质,主要由酸性多糖组成。CPS直接与细菌所处的环境接触,可保护细菌细胞免受宿主免疫机制的影响,包括抗吞噬和抗溶菌活性、免疫逃避和免疫调节,且CPS还具有免疫原性。大肠埃希氏菌(Escherichiacoli) Wza是一种保守的外膜脂蛋白,参与1族CPS通过外膜的输出,而Wzc是一种内膜酪氨酸自激酶。Wza-Wzc复合物可以跨越周质,连接内外膜,提供1族CPS输出途径,调节1族CPS的合成和输出。研究发现,RAwza缺失突变株未能产生CPS,缺失株具有更强的疏水性,更易自聚集,形成更多生物膜,毒性比野生型要低[8]。还发现RAwza和wzc双基因缺失影响了荚膜的生成、输出和细菌的生长,导致表面疏水性、自凝集能力、生物膜形成能力增强,降低了RA的致病性[8]。以上结果表明,wzc与wza均参与CPS的合成与输出,并影响RA的毒力。
2 细菌获铁系统相关因子
铁是大多数细菌的基本元素,铁离子是病原菌重要的生长因子。细菌的获铁系统在其感染宿主及致病过程起着重要作用。细菌获铁系统的蛋白同时也是重要的毒力因子。
2.1 TonB蛋白
TonB蛋白是革兰氏阴性菌细胞外膜的一种蛋白,参与铁等物质的运输。革兰氏阴性菌在生长繁殖过程中需要从外界摄取营养物质。一些小分子营养物质可以自由地通过革兰氏阴性菌的细胞膜,而一些大分子营养物质的转运需要特异性的TonB复合物依赖性外膜受体进行转运。TonB复合物由TonB、ExbB、ExbD构成,ExbB和ExbD蛋白质将TonB锚定在细胞质膜中,而作为能量传递蛋白的TonB作为二聚体跨越周质空间,与高丰度的外膜受体相互作用。TonB蛋白已被证明对许多细菌病原体的毒性至关重要。
RA预计包含2个TonB-ExbB-ExbD系统[9],即ExbB1-ExbD1-TonB1和ExbB2-ExbD2-ExbD29-TonB2。研究发现,RA CH3 株TonB1、TonB2基因缺失株CH3△tonB1、CH3△tonB2对Vero细胞的黏附和侵袭较亲本株显著降低,在雏鸭体内的LD50分别比CH3野生株高224倍和87倍,感染后雏鸭血液细菌载量均较CH3亲本株显著降低[9],表明TonB1和TonB2蛋白都影响RA的毒力。在L-半胱氨酸存在下,RA CH3可以利用血红素作为唯一的铁源,但CH3△tonB1出现血红素铁获取缺陷;进一步通过构建双突变体系统发现,只有当tonB1和tonB2都被突变时,RA CH1株血红素转运才被完全取消[9],表明TonB1和TonB2蛋白还通过参与血红素在RA中的转运,影响细菌获铁功能和毒力。
2.2 TonB依赖受体TbdR1
TonB依赖受体TbdR1是TonB系统中的一种外膜受体, TbdR1通过与TonB复合物相互作用,参与血红素铁的获取[10]。研究发现,在低铁环境下,RA CH3株tbdR1基因缺失株CH3△tbdR1比野生株和回补株生长速度慢,生物被膜形成能力较野生株显著降低,毒力也远远低于野生株[10],表明 TbdR1 是鸭疫里默氏菌的一种毒力因子。
2.3 铁载体相互作用蛋白
铁载体相互作用蛋白(siderophore-interacting protein,sip)参与调控铁载体基因的转录翻译过程,在铁离子转运的过程中起着重要作用。研究发现,RA CH3 株sip基因缺失突变株CH3△sip在限铁的条件下生长增殖缓慢且生物膜形成减少,对Vero细胞的黏附和入侵能力降低,对小鸭的LD50是亲本株的 35 倍[11]。还发现23/24(95.83%)RA强毒株具有sip基因[11]。以上结果表明,sip基因参与了RA的铁吸收且与RA的毒力相关。
除TonB、TbdR1和SIP外,据报道,RA血清1型菌株CH-1的B739-1343(编码 TonB 依赖性的转铁蛋白),B739-1208(血晶素受体基因)基因编码蛋白与铁的摄取有关[12-13]。研究发现,CH-1株B739-1343基因缺失株CH-1ΔB739-1343在缺铁环境下较亲本株生长受到明显抑制,且对鸭的致病力明显降低[12]。CH-1 株的B739-1208基因缺失株CH-1ΔB739-1208也丧失了对铁的摄取能力,生长能力和毒力较亲本株显著下降,感染后鸭血液、肝脏、脑组织的菌载量都显著降低[13]。以上结果表明B739-1343、B739-1208基因与RA的毒力相关。
3 细菌分泌系统相关因子
致病菌毒力因子的释放有赖于专属的分泌系统,许多革兰氏阴性细菌通过分泌系统将毒力因子从细菌的胞内分泌到宿主细胞或者环境中。已发现的革兰氏阴性细菌分泌系统有9个(Ⅰ型到Ⅸ型)。sprT、sprA基因是Ⅸ型分泌系统(T9SS)组成元件,研究发现,RA基因缺失株ΔsprT和ΔsprA对10日龄雏鸭的毒力均较亲本株显著下降,血液和脾脏组织中菌载量较亲本株低,且对鸭血清杀菌活性的敏感性较亲本株高[14]。通过构建RA Yb2菌株Tn4351转座子突变文库,筛选到与滑行运动及Ⅸ型分泌系统相关的gldG、gldK、gldM、gldL、gldN基因缺失株[15-20]。毒力测定结果显示,缺失株Yb2ΔgldG、Yb2ΔgldK、Yb2ΔgldM、Yb2ΔgldL、Yb2△gldN、Yb2ΔgldL-gldN毒力较Yb2亲本株分别下降了2 953倍、7 009倍、184倍、48倍、54倍、110倍[15-20]。缺失株Yb2ΔgldK、Yb2 ΔgldM、Yb2ΔgldL、Yb2△gldN、Yb2ΔgldL-gldN感染鸭组织中的细菌量均较亲本株显著降低[17-19],缺失株Yb2ΔgldK、Yb2 ΔgldM在滑行运动和蛋白质分泌方面存在缺陷[16-17]。对RA CH-1 的gldK基因缺失株进行研究也发现,CH-1ΔgldK感染后鸭血液、肝脏、脑组织的菌载量明显低于野生株,对鸭的LD50约为野生株的1.5×103倍,且对鸭的致死率显著低于野生株[20]。以上结果表明sprT、sprA、gldG、gldK、gldM、gldL、gldN基因与RAⅨ型分泌系统相关,Ⅸ型分泌系统与RA的毒力有关。
4 细菌调控相关因子
铁摄取调节(ferric uptake regulator,Fur) 蛋白可调控细菌对铁的摄取和利用,同时对广泛细胞过程(氧化还原胁迫反应、毒素与毒力因子)具有调控作用。研究发现,RA Fur缺失突变株感染产生的病理损伤较野生株轻,且毒力降低[21],提示Fur蛋白与RA的毒力相关。通过生物信息学分析发现RAYM-RS09735和RAYM-RS09740是1对PhoP/PhoR双组份调控系统。RAYM-RS09735/RAYM-RS09740双基因缺失突变株的LD50> 1011CFU,且缺失株在心脏、大脑、肝脏、血液和脾脏中的菌载量显著低于野生型,感染雏鸭后毒力显著降低[22],表明该双组份调控系统与菌株的毒力有关。预测发现信号转导反应调节因子(ArsR)和信号转导组氨酸激酶(SthK)位于同一操纵子上。通过构建ArsR/SthK双基因缺失突变株,发现该缺失突变株对鸭的毒力下降[23],提示ArsR/SthK双组份与RA的毒力有关。
5 其他
LuxE基因编码酰基蛋白合成酶(luxE),该酶激活脂肪酸,形成脂肪酰AMP介导物,并作为生物发光脂肪酸还原系统的第二步发挥作用。研究发现,luxE基因缺失株Yb2ΔAS87-03730在TSB中的生长速度和对Vero细胞的侵袭能力均较亲本株显著降低,LD50约为亲本株的80倍,提示AS87-03730与RA的毒力相关[24]。
烟酰胺酶A(PncA)是催化烟酰胺转化为烟酸的关键酶,是NAD挽救途径中的一个重要反应,影响病原体在细胞内的复制和传播。通过转座子技术获得pncA(AS87 U 01735基因编码)基因缺失株Yb2ΔpncA,与野生株Yb2相比,缺失株Yb2ΔpncA感染鸭血液中的细菌含量较低,心脏、肝脏和脾脏没有明显的组织学变化,对Vero细胞的黏附入侵能力下降,对鸭的毒力下降了488 000倍[25]。表明AS87-03730与RA的毒力相关。
RIA-1614基因(RanB)是RA菌ABC的外排泵组分。研究发现,RA-GD菌株的RIA-1614基因缺失株RA-GD△RIA-1614的LD50值是亲本株的43倍,感染雏鸭后的血液细菌载量比亲本株降低了38倍,提示RIA-1614蛋白参与了菌株的毒力[26]。
除去以上概述的各种毒力相关因子,已报道的RA毒力相关因子还有CH3株M949-RS00050基因[27]、Yb2株AS87-RS09170(bioF)基因[28]、CH-1株B739-0373基因[29],CH-1株dps基因[30]等。
6 小结
鸭疫里默氏菌作为重要的水禽细菌病病原之一,一直受到研究者的高度关注。该菌引发的疫情多发生于鸭群,但近几年鹅群暴发该病的报道逐渐增多。虽然商品化的RA疫苗已经广泛应用于水禽养殖,但生产中该病仍较多发生。且由于抗菌药物的不规范使用导致耐药菌株持续增加,使得RA在水禽养殖中的感染更为普遍和严重。
近年来,越来越多的鸭疫里默氏菌毒力相关因子被发现和研究,基于毒力因子的基因缺失疫苗研究也在不断探索。由于RA的毒力因子多种多样,不同毒力因子在致病过程中发挥的作用也不同。目前很难确定哪种毒力因子在致病过程中占主要地位,且毒力因子在细菌致病过程中的协同作用也需进一步明晰。鉴于细菌毒力系统的复杂性,未来仍有很多问题需要解决。因此,需要进一步探究已知毒力因子的功能,探索已知毒力因子在致病过程中的协同作用,以及鉴定新的毒力相关因子,为阐明RA的致病机制、防治措施提供依据,同时也为新型药物和疫苗的研发提供新的思路。
动物医学论文范文 第11篇
题目:猪繁殖与呼吸综合征病毒NSP4研究进展
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染引起的一种高度接触性传染病。PRRS俗称猪蓝耳病,由于PRRSV入侵会降低生猪免疫力,常伴随混合感染而使疾病很难得到有效防控。1987年该病首次在美国报道,1990年荷兰成功分离PRRSV并命名Lelystad virus(LV)株,1991年在美洲分离出VR2332株,2种PRRSV基因组序列差异较大并分别命名为欧洲株基因Ⅰ型和美洲株基因Ⅱ型。1996年中国首次成功分离到PRRSV[1],命名为CH-1a。刘光清[2]等对PRRSV CH-1a株ORF1进行测序分析,结果表明ORF1全长11882 bp,与LV株同源性较低,与VR2332株同源性较高。2006年中国暴发以高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV)为主要病原的“高热症”[3],HP-PRRSV成为中国具有更高致病力流行株,2015年以后NADC-30 like毒株为流行毒株[4],给中国养猪业造成更严重损失。目前一直没有针对该病毒的有效药物,疫苗的效果也有限,不断重组与变异的PRRSV使得PRRS防控形势更加严峻。
PRRSV是一种不分节段、有囊膜单股正链RNA病毒,核衣壳外围包被脂质双层膜,对一些脂类溶剂如乙醚、氯仿敏感,这些物质会溶解脂质双层膜而使病毒失活。PRRSV 基因组包括10个开放阅读框(open reading fame,ORF)。ORF1a和ORF1b占据整个PRRSV基因组3/4,翻译形成2个多聚蛋白pp1a和pp1ab。pp1a和pp1ab可被NSP4水解成13个非结构蛋白,即NSP lα、NSP lβ及NSP2~NSP12,PRRSV基因组编码8个结构蛋白GP2a、E、GP3、GP4、GP5、GP5a、M、N。
NSP4具有3C样丝氨酸蛋白酶(3CLSP)活性,最适温度为8℃,最适pH为7.5,该酶能够适应高浓度Na+环境,对二价金属离子(Zn2+、Cu2+)具有较高敏感性且蛋白酶抑制剂乙二胺四乙酸(EDTA)和苯甲基磺酰氟(PMSF)能抑制NSP4 3CLSP活性。NSP4可通过铰链区(hinge region)信号作用主动进入细胞核,因此细胞核存在大量NSP4而细胞浆少量存在,铰链区145-168位氨基酸可影响NSP4核定位。很多病毒与宿主相互作用过程中通过抑制IFN逃避宿主免疫反应,其中PRRSV NSP4能抑制IFN-I产生,且该抑制作用与3CLSP 活性密切相关。PRRSV 3CLSP晶体结构由3部分组成,2个反向平行β折叠桶(结构域Ⅰ和结构域Ⅱ)和1个C末端α/β结构域(结构域Ⅲ)。NSP4 3CLSP活性区域位于结构域Ⅰ和结构域Ⅱ之间,第39位组氨酸(His)、第64位天冬氨酸(Asp)和第118位丝氨酸(Ser)构成His-Asp-Ser 催化三联体,是NSP4发挥3CLSP活性重要氨基酸位点,这3个氨基酸突变会使3CLSP丧失蛋白酶活性[5]。NSP4 3CLSP参与诱导细胞凋亡反应,可以作为一种重要靶蛋白揭示PRRSV复制机理。NSP4在PRRSV复制早期出现,PRRSV感染早期可在宿主体内检测到NSP4抗体[6]。对NSP4功能进一步解析,将有助于探索PRRSV免疫逃逸与持续感染,为防控PRRS提供理论基础。作者对NSP4遗传变异、对病毒复制影响、诱导细胞凋亡、调节宿主免疫、调控抗病毒反应、与宿主相互作用、在PRRSV检测方面进行综述,为疫苗设计与开发药物提供理论参考。
1 NSP4遗传变异分析
NSP4基因高度保守,董建国[7]通过对HP-PRRSV HuN4株与PRRSV CH-1a株NSP4氨基酸序列进行比对,发现高致病性HuN4株和CH-1a株NSP4 氨基酸(aa)相似性高达96.5%,仅在7个aa位点存在差异,CH-1a株的第6、76、80、154、178、185、186位的氨基酸分别为精氨酸(Arg)、丙氨酸(Ala)、苏氨酸(Thr)、缬氨酸(Val)、缬氨酸(Val)、缬氨酸(Val)、异亮氨酸(Ile),而HuN4株则分别为苏氨酸(Thr)、缬氨酸(Val)、丙氨酸(Ala)、赖氨酸(Lys)、异亮氨酸(Ile)、天冬氨酸(Asp)、苏氨酸(Thr)。此外,NSP4催化三联体His39-Asp64-Ser118序列保守性高,未发生突变。其中PRRSV NSP4第185位天冬氨酸(Asp)发生突变,影响NSP4切割核转录因子(NF-κB)必要调节蛋白(NEMO)和MAVS的能力,从而调控IFN-Ⅰ表达[8]。其他氨基酸突变是否对空间构象造成影响,该影响是否与病毒毒力、细胞噬性相关,还需进一步试验验证。Wang[9]等发现NADC30-like株与国内流行疫苗株在NSP4发生重组,是否影响疫苗效果还需进一步研究。
2 NSP4对病毒复制影响
在非结构蛋白前体多聚蛋白pp1a和pp1ab加工过程中,NSP4作为一种重要的复制和转录酶,切割PRRSV增殖过程中的多聚蛋白,并且NSP4负责NSP3~NSP12切割。Tian[10]等通过人工合成10条多肽并以之为底物(含NSP4预测切割位点),通过“多肽底物-反相高效液相色谱”方法体外测定蛋白酶活性,发现NSP4可顺式切割NSP4-NSP5,Tian[6]等证实NSP4可反式切割NSP3-NSP4和NSP11-NSP12,NSP4不能在体外切割NSP8-NSP9[11]。董建国[7]利用大肠埃希氏菌表达系统表达并纯化PRRSV HuN4株和CH-1a株NSP4重组蛋白,建立体外测定NSP4酶动力学方法,以及PRRSV NSP4荧光定量PCR方法,结果表明CH-1a NSP4体外切割NSP11-NSP12效率高于HuN4株,但HuN4株NSP4基因转录水平高于CH-1a株,导致整体上HuN4 NSP4酶催化效率高于CH-1a株,进而快速切割NSP11-NSP12。NSP11可抑制IFN-β产生和宿主先天性免疫,有利于PRRSV增殖,使得相同时间内 HuN4株病毒粒子生成数量多于CH-1a株。Liu[12]等从含骆驼重链抗体可变区噬菌体展示文库中分离出3个PRRSV NSP4特异性纳米抗体(Nb41、Nb42、Nb43),利用慢病毒载体将纳米抗体基因导入Marc-145细胞,测试这些细胞内表达的纳米抗体与PRRSV NSP4是否互作。结果表明,Nb42识别NSP4非功能表位,Nb41和Nb43通过识别NSP4功能表位抑制PRRSV复制 ,并在0.001感染复数(MOI)或更低感染复数下完全阻断PRRSV复制。
3 NSP4诱导细胞凋亡
在PRRSV所有结构和非结构蛋白中,NSP4作为最主要凋亡诱导蛋白,一方面可激活促凋亡蛋白Bim,另一方面能够降解抗凋亡蛋白Bcl-xL,诱导细胞凋亡,凋亡与其3CLSP密切相关[13]。在凋亡过程中,NSP4发挥生物学功能需要宿主细胞蛋白参与,NSP4可以与细胞色素C1(cyto.c1)蛋白互作。NSP4和cyto.c1能在细胞质中共定位,NSP4剪切cyto.c1蛋白具有剂量依赖性特点,而且NSP4任一酶活性氨基酸位点突变均丧失剪切cyto.c1蛋白能力,cyto.c1蛋白E230aa-G231aa是决定NSP4能否切割cyto.c1蛋白关键位点[14]。
4 NSP4调节宿主免疫
NSP4在调节宿主免疫方面发挥极其重要的作用。NF-κB必要调节蛋白NEMO是诱导IFN产生的关键蛋白,仙台病毒(SEV)作用于NEMO缺陷型小鼠胚胎成纤维细胞(MEF)时,MEF由于缺失NEMO使干扰素调节因子3(IRF3)磷酸化过程受阻,导致IFN-β产生受到抑制。PRRSV感染猪肺泡巨噬细胞(PAM)可抑制IFN-β表达,该抑制作用通过NSP4切割NEMO途径实现。NSP4在细胞质多个位点与NEMO特异性的相互作用。Chen J Y等研究表明将PRRSV NSP4 第64位的D突变为A后,发现野生型NSP4(NSP-WT)能够切割宿主蛋白NEMO,而酶活性缺失体不能切割NEMO,得出该切割作用与NSP4酶活性有关,酶活性缺失体不能抑制IFN-β表达[15]。
线粒体定位抗病毒蛋白(MAVS也称IPS-1、VISA或CARDIF),缺失会减弱机体对IFN-β的诱导作用。不同PRRSV对IFN-β抑制作用不同,黄琛[16]在PAM验证出HP-PRRSV NSP4比传统株CH-1a NSP4对IFN-β抑制作用更强,HP-PRRSV感染明显下调VISA蛋白水平,但 CH-1a对VISA表达没有作用。HP-PRRSV NSP4能够切割维甲酸诱导基因-I(RIG-I)/黑色素瘤相关基因5(MDA5)信号通路中重要接头分子MAVS及NEMO,NSP4能够同时抑制IRF3磷酸化和NF-κB活化。HP-PRRSV NSP4切割MAVS及抑制IFN-β的产生依赖其3CLSP活性,与蛋白酶体和细胞凋亡途径无关。HP-PRRSV NSP4切割接头分子MAVS的位点位于MAVS第268位谷氨酸(Gln),切割之后形成两个片段,使得MAVS丧失诱导IFN-β能力。
NSP4抑制IκB激酶复合体α(IκB kinase α,IκKα)对IFN-β的诱导表达。PRRSV NSP4作为一个丝氨酸蛋白酶与IκKα相互作用,在IκKα两端特异切割IκKα,NSP4蛋白酶活性在抑制IκKα激活NF-κB通路和IFN-β启动子活性中发挥关键作用,其NSP4保守氨基酸序列His39-Asp64-Ser118催化三联体任一位点发生氨基酸突变都会影响对IκKα切割,该结果有助于揭示PRRSV逃逸宿主天然免疫机制[17]。
NSP4切割信号转导及转录激活酶2(STAT2)抑制IFN-β表达。PRRSV NSP4蛋白在拮抗JAK-STAT信号通路中发挥重要作用,PRRSV NSP4蛋白依赖其自身丝氨酸蛋白酶活性切割JAK-STAT信号通路中重要信号分子STAT2。在JAK-STAT信号通路传递途径中,STAT2与STAT1结合形成异源二聚体,NSP4切割STAT2致使异源二聚体缺乏,干扰素刺激基因因子3(ISGF3)复合体不能与干扰素刺激元件ISRE结合,拮抗IFN-β生成,同时鉴定出NSP4切割STAT2位点是E719[18]。
NSP4可通过多种途径切割多个信号分子来实现对IFN-β的调控,相关研究表明NSP4氨基酸突变对NSP4诱导IFN-β产生影响。NSP4在细胞核抑制IFN-β产生,NSP4第155位苏氨酸(Thr)被赖氨酸(Lys)取代可以增加NSP4在细胞核中的分布,从而抑制IFN-β体外转录[19]。HP-PRRSV NSP4第185位天冬氨酸(Asp)发生突变,会使NSP4切割NF-κB必要调节蛋白(NEMO)和MAVS能力受损,从而拮抗IFN-β产生[8]。
丁国飞[20]等通过NSP4蛋白质组学方法筛选到包括转绿因子Snf2相关CBP激活蛋白(SRCAP)在内的42个可能与NSP4互作细胞蛋白,进一步发现PRRSV感染细胞后,NSP4与SRCAP互作激活Notch信号通路,从而促进PRRSV的增殖与复制,揭示了一种全新PRRSV感染机制。
巨噬细胞清道夫受体A(SRA又称CD204),可以帮助吞噬细胞识别致病菌。有报道PRRSV侵入机体后,NSP4可通过直接与SRA启动子-84到-214区域结合抑制SRA基因转录,帮助PRRSV逃逸宿主免疫反应。通过与紫外线(UV)灭活的 PRRSV 比较,未灭活的PRRSV感染抑制 SRA转录,紫外线UV灭活的PRRSV不能抑制SRA转录,NSP4调控 SRA转录与PRRSV复制有关[21]。
猪感染HP-PRRSV会阻滞猪白细胞抗原Ⅰ类(SLA-Ⅰ)抗原呈递途径。HP-PRRSV感染抑制β2微球蛋白(β2M)的表达,β2M与SLA-I重链和可变肽形成异源三聚体复合物,在SLA-Ⅰ抗原呈递过程中发挥着关键作用[22]。NSP4外源性表达在mRNA和蛋白质水平下调β2M的表达,并降低细胞表面SLA-Ⅰ表达。
5 NSP4调控抗病毒反应
PRRSV感染Marc-145细胞显著下调外源性锌指抗病毒蛋白(ZAP)表达,NSP4利用3CLSP切割ZAP,从而拮抗ZAP抗病毒作用,NSP4第180位丝氨酸(Ser)是降解ZAP所必需,180位氨基酸突变下调PRRSV降解ZAP能力,从而拮抗其抗病毒作用[23]。杨玉婷[24]通过Western blot发现NSP4在E411位点切割ZAP的能力与NSP4含量呈正相关,自噬溶酶体途径和泛素-蛋白酶体途径不影响NSP4切割ZAP,NSP4酶活突变体丧失对ZAP切割能力,NSP4切割ZAP依赖3CLSP。mRNA脱帽酶1a(DCP1a)是一种免疫调节因子,参与从真核mRNA中去除5′-甲基鸟苷帽,被鉴定为干扰素刺激基因,NSP4也可切割猪mRNA脱帽酶1a(pDCP1a)。PRRSV感染不影响pDCP1a mRNA转录和亚细胞定位,通过切割pDCP1a显著下调pDCP1a的表达,从而致弱pDCP1a抗病毒活性,切割位点位于pDCP1a第238位谷氨酸(E238)[25]。
6 NSP4与宿主相互作用
猪核糖核酸酶L(sRNase L)是一种干扰素诱导产生的抗病毒蛋白,sRNase L激活后参与一系列机体免疫反应,抑制PRRSV在宿主细胞增殖。张梅洁[26]通过构建荧光素酶活性试验发现与sRNase L互作的PRRSV蛋白是NSP4、NSP12和N,且在细胞内共定位。尹曼曼[27]筛选PAM cDNA文库中与NSP4相互作用的宿主蛋白,发现猪免疫球蛋白lambda轻链相似肽5(sIGLL5)与NSP4互作,NSP4和sIGLL5在HEK-293细胞共定位。PRRSV感染过程中,NSP4可通过与TRIM蛋白家族成员TRIM28互作,介导部分TRIM28以核转录蛋白CRM1依赖方式从细胞核转移至细胞浆中。出核TRIM28作为E3泛素连接酶,使早期自噬调控分子Vps34发生类泛素蛋白修饰,增强Vps34和自噬关键调控蛋白复合物Beclin1互作,进而调控细胞自噬体形成[28]。该研究揭示了PRRSV诱导细胞自噬的新分子机制,从蛋白翻译后修饰角度阐明了PRRSV与宿主细胞的互作机制。RBM39(RNA binding motif protein 39)通过与NSP4互作调节c-Jun磷酸化,进而促进PRRSV感染[29]。此外NSP4可与F-action和myosin ⅡA互作,完成PRRSV在细胞之间的传递与感染[30]。
7 NSP4在PRRSV检测方面应用
NSP4在病毒复制早期出现,并切割其他非结构蛋白,在PRRSV复制周期中存在较长时间,机体感染早期可检测到NSP4抗体,可用于检测PRRSV早期感染。同时,NSP4主要是在病毒复制过程中产生,用NSP4作为诊断抗原检测NSP4抗体可区分自然感染与灭活疫苗免疫接种。Brown E[31]等克隆表达VR2332株NSP1、NSP2、NSP4、NSP7和NSP8,并且以这些蛋白作为包被蛋白分别建立ELISA方法,结果表明NSP2 ELISA和NSP7 ELISA检测效果最好,NSP4 ELISA与待检血清反应弱于前两者。刘磊[32]等以NSP4重组蛋白作为包被抗原,建立了NSP4抗体ELISA检测方法,并与爱德士IDEXX ELISA检测结果对比,总符合率为93.19%,结果说明PRRSV NSP4是具有良好潜力的候选蛋白。Cao[33]等开发NSP4蛋白包被间接ELISA(NSP4涂层iELISA),并将其效果与N涂层iELISA进行了比较,结果表明NSP4涂层和N涂层iELISAs之间一致性为92.2%。此外,检测了50份接种HP-PRRSV猪血清样本,用NSP4包被iELISA检测出PRRS抗体阳性,但N包被iELISA检测结果阴性,Western blot分析结果与NSP4包被和NSP2包被iELISA分析结果一致性分别为92%和96.1%。结果表明大部分采集自接种活HP-PRRSV菌株的猪血清样本,其N包被iELISA检测结果阴性,NSP4包被iELISA检测结果阳性,因此使用NSP4包被iELISA可以帮助区分HP-PRRSV疫苗的假阴性和真阴性反应。
8 小结
PRRSVNSP4参与多种免疫抑制反应,NSP4具有3CLSP活性,在PRRSV复制、抑制宿主IFN-β产生、诱导宿主细胞凋亡以及在PRRSV检测等方面具有重要作用[9,34]。PRRSV NSP4基因保守性较高,不同PRRSV之间氨基酸相似性高,根据这一特性未来可开发出针对PRRSV 的高效新型检测试剂与检测方法。
PRRSV作为一种免疫抑制性病毒,进化出多种策略逃逸宿主抗病毒天然免疫反应。PRRSV除了能抑制IFN-β产生,还可靶向干扰素诱导基因(ISGs)拮抗宿主抗病毒反应。研究病毒如何逃逸宿主免疫有助于深入解析宿主免疫反应调控机制。作为PRRSV编码的一种重要蛋白酶,NSP4在拮抗宿主天然免疫反应中发挥重要作用,NSP4除拮抗IFN-Ⅰ信号通路,还可激活Notch信号通路、调控抗原呈递途径、参与诱导细胞凋亡等方面协助病毒逃逸宿主免疫应答。NSP4与多种宿主蛋白互作,NSP4具有切割宿主蛋白的作用,这可能成为PRRSV 逃逸宿主免疫反应的主要机制之一。深入研究PRRSV NSP4调节宿主免疫反应机制有助于深入了解PRRSV致病机理并确定其毒力因子,以此为前提可为弱化PRRSV、开发有效疫苗提供新靶点和理论基础。
PRRSV NSP4作为主要蛋白酶之一,在病毒增殖中发挥重要作用,3C样丝氨酸蛋白酶特征成为药物设计重要靶点[17,19]。纳米抗体作为治疗PRRSV感染的新型抗病毒药物,有巨大发展潜力。Shi[35]团队开展靶向NSP4抗病毒药物筛选,得到2种抑制效果显著的抗病毒候选药物。迄今为止,PRRSV仍在全球流行,对养殖业危害巨大,有效防控PRRSV仍是世界性难题,研究PRRSV分子致病机制可为预防与控制该病提供科学依据。
动物医学论文范文 第12篇
题目:猫毛滴虫病研究进展
毛滴虫是一类属于副基体门的原虫,以寄生或共生形式、厌氧生活在宿主胃肠道或生殖道,多有3根~5根前鞭毛、氢酶体、副基体及复杂的细胞骨架等结构[1-2]。猫毛滴虫感染已报道的虫种有寄生于猫肠道的胎儿三毛滴虫(Tritrichomonasfoetus)和人五毛滴虫(Pentatrichomonashominis)及寄生于猫口腔中的口腔毛滴虫(Trichomonastenax)、布里克西毛滴虫(Trichomonasbrixi)和猫四毛滴虫(Tetratrichomonasfelistomae)等[2-3]。T.foetus是引起猫毛滴虫病的病原,临床上以慢性大肠性腹泻为特征[4]。分子分析显示牛和猫T.foetus分离株在遗传上有一定差异,分属于T.foetus的“牛基因型”和“猫基因型”[4-5]。猫作为伴侣动物,与人接触密切,这引发了人们关于猫是否可引起毛滴虫人兽共患传播风险的担忧。
1 发现历史
猫毛滴虫的研究可追溯到20世纪20年代,Da Cunha A M和Muniz J将其命名为猫毛滴虫(Trichomonasfelis)。1996年,Romatowski J基于光镜观察,把猫粪中的滴虫鉴定为P.hominis;2001年Levy MG首次用分子方法证实T.foetus才是猫滴虫性腹泻的真正病原[6-7]。
2 病原与生活史
毛滴虫仅有滋养体阶段,通过纵二分裂进行繁殖,不同虫种滋养体形态相似,均呈纺锤形或泪滴状,具特定数量的前鞭毛和1 根与波动膜边缘连接的后鞭毛,虫体运动活泼[1]。其中,T.foetus有3根前鞭毛,P.hominis有5根前鞭毛,T.tenax有4根前鞭毛。目前认为猫T.foetus主要经粪-口途径传播,而寄生于口腔的毛滴虫通过飞沫或接触传播[3,6,9]。
3 致病性
3.1 胎儿三毛滴虫
猫毛滴虫病作为一种新发的猫胃肠道疾病,其发病机制尚不明确。自然感染情况下,T.foetus主要定植在黏膜表面,并与盲肠和结肠的表面上皮接触。人工感染试验可观察到虫体定植在猫回肠末端、盲肠和结肠。体外研究表明,T.foetus可经特异性配体-受体互作直接黏附在单层肠上皮细胞上[10]。半胱氨酸蛋白酶似乎可介导虫体在肠黏膜上皮的黏附和细胞毒作用,未来可作为改善该病临床症状的治疗目标[11]。
3.2 口腔毛滴虫
T.tenax感染多见于口腔卫生较差或具牙周疾病的人群[3]。虽然T.tenax具较高蛋白水解活性,可破坏寄生部位黏膜和组织,但普遍认为其与宿主是一种共生关系[9]。
4 临床症状
猫毛滴虫病临床症状多变,感染较轻时呈亚临床症状,严重感染时出现慢性顽固性腹泻。人工口服攻虫后,猫可出现慢性或间歇性腹泻,粪便呈半成形,半流质或液态,黄绿色,恶臭,有时有粪便带血、黏液,大便失禁、里急后重,肠胃胀气等症状,可持续2 d~7 d。严重感染病例,会出现明显肛门炎症和直肠脱垂等[1,6]。上述临床症状多呈间歇性,在使用药物治疗后好转,停药后可复发[12]。
5 流行
5.1 猫肠道毛滴虫
猫T.foetus呈全球流行,猫T.foetus感染率为0~81.8%,见表1[6]。不同的研究者调查时采用的方法不尽相同,早期的调查多采用培养法和直接涂片镜检,近期多采用分子方法,一些国家仅有猫T.foetus病例报道,尚无猫群中T.foetus流行的相关数据可供参考[13]。现有研究中,调查样本来源多样,如采集自腹泻猫、参加会展的猫、寄养猫、或兽医诊所就诊猫等,有的样本有临床症状,有的无临床症状等,因此现有流行数据可能存在与此类样本、调查方法等相关联的偏差[13]。一些早期病例报道中,曾把T.foetus误判为P.hominis。近期关于猫P.hominis流行的报道也不多,目前仅见日本宠物店猫P.hominis感染率为0.5%(2/409),国内某动物医院门诊猫P.hominis感染率为5.3%(3/57),且存在T.foetus和P.hominis混合感染,混合感染率为3.5%(2/57)[15-16]。
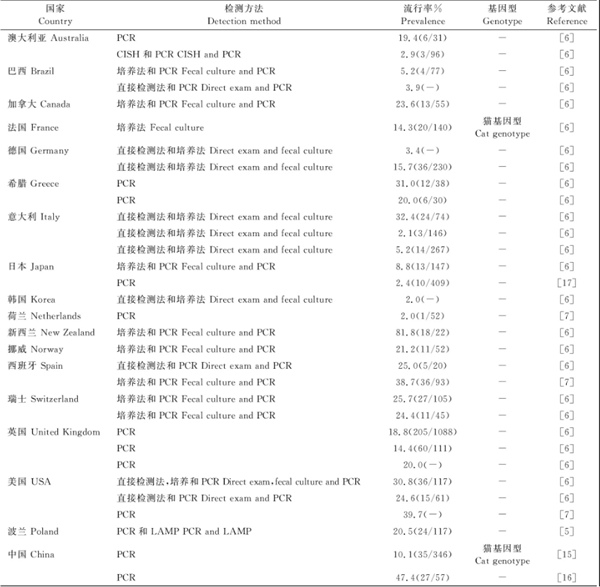
表1 全球猫T.foetus流行情况
5.2 猫口腔毛滴虫
Kellerov P和Tachezy J[3]报道捷克猫T.tenax感染率为4.1%(5/111),T.brixi感染率为6.6%(7/111)。Dybicz M等[5]报道波兰猫T.tenax感染率为2.1%(3/142)。
6 诊断
常用的诊断毛滴虫病的方法有直接湿片镜检法、粪便培养法和PCR法。毛滴虫滋养体对环境较敏感,其诊断对粪便样本有较高的要求。待分析粪便必须新鲜、无污染,且测试前不要冷冻。最好采集刚排出的新鲜粪便或用粪圈或结肠冲洗技术人工提取粪便[1,6,17]。如样本需运输,可用盐水(每2 g粪便用3 mL生理盐水)稀释,防止干燥以延长毛滴虫存活时间。为提高检测敏感性,粪便样品最好在6 h内分析完毕,如超过6 h,会降低检测敏感性[1]。非腹泻猫的粪便或干结粪便,不适合用于毛滴虫检测,因即使存在感染,也很少会有阳性结果。在猫服用抗生素的情况下采样,会降低毛滴虫检出率,因此在采样前,最好提前几天停用任何类型的抗菌治疗[1]。
6.1 直接湿片镜检法
将少量粪便用生理盐水稀释后,盖上盖玻片,置200×或400×镜下检查,即“湿片”法。观察时,可根据滋养体形状和运动特点发现虫体,一旦虫体不运动或死亡,则很难检出。该法操作简单、成本低,但检测敏感度较低,其中人工感染猫检出率低于2%,自然感染猫检出率约4%。实践中,可用新鲜、非冷藏(冻)和腹泻猫粪便及多次涂片检查等提高检出率[6]。此外,该法不能区分T.foetus和P.hominis等不同毛滴虫虫种,同时因T.foetus滋养体大小与贾第虫包囊大小相似,容易混淆,镜检时要注意排除干扰。 对T.tenax,则直接取猫口腔刮取物,用生理盐水稀释、涂片后镜检。
6.2 粪便培养法
如粪便经多次镜检仍为阴性,可用商业化的In Pouch TF培养基进行虫体培养。该法仅需少量粪便(米粒大小即可),敏感性比直接镜检高,自然感染猫检出率约55%。因贾第虫不能在该培养基上生长,可排除贾第虫包囊对结果的干扰[1]。但该法耗时较长,需几天时间让虫体增殖以提高检出率,且该法也不能区分不同毛滴虫虫种。此外,也可用Diamond或改良Diamond培养基等对粪便进行培养后检测。
6.3 PCR方法
目前,已发展了多种检测猫毛滴虫的PCR方法,主要扩增的靶基因为毛滴虫5.8S rRNA的ITS1和ITS2区。最常用的方法是巢式PCR法,第一对引物为TFR3和TFR4(扩增347 bp的片段),第二对引物为TFITS-F和TFITS-R(扩增208 bp的片段)[18]。已证实引物对Th3/Th5是P.hominis特异的,在其基础上发展出的单轮和巢式PCR方法是较为常用的方法[22-23]。Kikuta N等[21]发展了一种特异检测T.tenax的PCR方法。PCR方法的敏感性和特异性均优于粪便培养法和直接湿片镜检法,所需时间比培养法短,且不要求必须是活虫体,死亡虫体也可检测,可检测至最低10个虫体/100 mg粪便[22]。但因粪便成分复杂,如多糖复合物、胆盐、血红蛋白降解产物、酚类化合物和重金属等PCR抑制剂常与虫体DNA共同提取,会降低检测的敏感性,导致出现“假阴性”[6]。
6.4 组织病理学方法
组织病理学法可作为检测肠组织中P.hominis/T.foetus滋养体的一种诊断方法,但因滋养体极其脆弱,很难保存在活检标本中,因此检测结果并不准确[6]。使用该法时,对同一样本,需检查至少6个组织切片,以获得至少95%的置信度[1]。免疫组织化学、荧光原位杂交与显色杂交技术也可应用于组织标本中毛滴虫的检测,但不易推广应用。
7 治疗
通常治疗人阴道毛滴虫等肠道原虫的药物,如甲硝唑和替硝唑,在治疗猫毛滴虫病时效果不佳。罗硝唑(RDZ)是迄今唯一已证实对猫T.foetus有效的药物,通常按每天20 mg/kg~30 mg/kg剂量口服,连用14 d[1]。在用RDZ治疗期间,大多数感染猫的粪便稠度能快速改善,一般在治疗2周后正常[1]。但一些结肠损伤严重的病例,治疗数周腹泻仍不见好转。因从肠道彻底清除毛滴虫难度较大,用RDZ治疗后,毛滴虫病可能会复发,但经多次治疗的猫可痊愈[23]。用芬苯达唑、帕罗霉素、替硝唑和甲硝唑等治疗毛滴虫病时,治疗期间,猫粪便状况有所改善,但停药后腹泻经常重现[6]。有报道显示猫毛滴虫可对RDZ产生抗药性,但感染猫群中抗药性虫株的流行情况不甚清楚[24]。高剂量应用RDZ,可使猫产生食欲减退、颤抖、虚弱、共济失调和感觉过敏等副作用。因副作用的存在,只有在已明确确诊为毛滴虫感染的病例、且已征得猫主人同意,才建议应用RDZ治疗[12]。
目前报道的其他治疗猫毛滴虫病的方法较少。许多有效治疗腹泻的办法如改变饮食,使用不同类抗菌素、益生菌和营养补充剂等,对治疗猫毛滴虫病效果均不明显[25]。
8 预后
猫毛滴虫病的预后往往良好,感染T.foetus的猫仍可保持正常身体条件和生理状态。88%的腹泻猫,其粪便可在感染2年后自然恢复正常。平均腹泻持续时间为135 d。然而,T.foetus感染很难自发消除,暗示猫很难对T.foetus感染产生有效的免疫反应,约54%的猫存在持续感染或再次感染,或间歇性腹泻反复发作等,推测可能与应激或肠道菌群变化相关。此外,慢性感染可能会使部分猫发展为炎症性肠病[6,12]。
鉴于猫毛滴虫病预后良好,当感染发生后,治疗与否成为一个必须抉择的问题。欧洲猫科疾病咨询委员会推荐,仅当腹泻的猫经直接湿片镜检和粪便培养后镜检为毛滴虫阳性时,建议进行治疗[1]。很多猫感染后无临床症状,但其可能成为潜在的传染来源。因此,建议所有经检测毛滴虫阳性的猫,无论有无症状,均应进行治疗,以尽量减少该病的传播。
9 预防
因应激或免疫功能发育不成熟,在拥挤环境中饲养的小猫更易发生T.foetus感染。因此,减少应激,避免密集饲养,以尽量减少接触或感染T.foetus的机会。此外,应对所有被T.foetus污染的猫舍、床、被褥、运输箱、垃圾箱等进行彻底消毒,以杀死污染的滋养体[6,12]。
10 展望
猫毛滴虫病作为一种猫的新发传染病,已引起兽医界的关注。目前对该病的研究远未达到预期,尤其急需有效、安全的治疗办法。继续开展猫毛滴虫病的病原学、流行病学、传播模式、致病性、人兽共患潜力等研究,有助于更全面的掌握其情况,从而为防控奠定基础。
动物医学论文范文 第13篇
题目:牛呼吸道疾病两种细菌性病原研究进展
牛呼吸道疾病(Bovine respiratory disease,BRD)是一种由多种因素引起的综合征,包括环境和管理相关的应激源以及多种病毒和细菌病原体,给北美和世界养牛业造成巨大的经济损失,目前仍然是影响北美地区肉牛最常见和损失最大的疾病,也是引起奶牛发病和死亡的重要原因[1]。我国目前尚未研制防控BRD的相关疫苗,防控措施较为单一,建议深入开展致病机理及防控技术研究,开发有效的诊断试剂与疫苗,对高效防控该类疾病,保障养牛业的健康、快速、可持续发展具有重要意义[2-3]。Dubrovsky S A等[4]报道美国加州的饲养场中BRD的发病率约为75%和病死率接近50%;育肥场的发病率更高,初步估计发病率和病死率约为90%。而在奶牛养殖场中,断奶犊牛BRD的发病率约为22%和病死率约20%,也是导致断奶前犊牛死亡的主要原因。
BRD的发生是由多种因素引起并最终导致受感染牛表现临床症状,但引起发病的细菌性病原体主要是溶血性曼氏杆菌(Mannheimiahaemolytica,Mh)和多杀性巴氏杆菌(Pasteurellamultocida,Pm)[5]。这些病原体已经适应并定植于呼吸道黏膜表面,从而逃避宿主的免疫反应;适应机制包括表达黏附素、产生和分泌毒素与蛋白酶以及形成生物膜。耐药性是BRD病原菌中的一个新问题,而Mh广泛耐药(extensively drug-resistant,XDR)菌株的分离越来越普遍[6-7]。本文对引起BRD的两种主要细菌性病原体的生物学特性、免疫逃避和致病机制、耐药性与耐药现状及多重耐药的遗传机制,以及这些因素如何影响对此类疾病的诊断、治疗和疗效等进行简要概述,以期为我国防控该病提供参考。
1 Mh与Pm概述
Mh和Pm是巴斯德菌科的革兰氏阴性兼性厌氧菌,通常定植于临床健康牛的口咽部黏膜上。一般来说,这些微生物引起牛的临床疾病是由应激、免疫抑制和病毒感染的共同作用导致的,最终导致其在下呼吸道的过度生长。越来越多的证据表明其具有传染性,至少Mh可在种群内传播[8-9]。
多杀性巴氏杆菌由5种荚膜血清型(A、B、D、E、F)和16种菌体血清型(1-16)。相比之下,溶血性曼氏杆菌至少由12种荚膜血清型(1、2、5-9、12-14、16和17)组成。对于两种病原体,荚膜血清型是引起宿主特异性和致病性的原因。尽管存在不同的血清型,但临床疾病多集中在荚膜血清A1型Mh(>75%的病例)和荚膜血清A3型Pm(肉牛>30%和奶牛>60%的病例)。Cozens D等[10]的研究表明,A1型Mh的特异性毒力因子促进了其在牛呼吸道上皮细胞的侵袭,使其能够进行不受控制的复制并扩散到邻近的细胞;一旦进入细胞,能对受感染的组织造成广泛的损害,同样的现象没有在呼吸道共栖的血清型中发现[10]。
除了荚膜型外,这两种微生物都是革兰氏阴性菌,其特征是细胞外壁存在脂多糖(LPS)。内毒素是一种强有力的促炎介质,可触发细胞因子的释放,并刺激炎症细胞的涌入,从而导致疾病的发生。此外,内毒素与白细胞毒素协同作用可以增强Mh的致病性。
2 Mh与Pm的免疫逃避和致病机理
许多革兰氏阴性病原体已经进化出在黏膜表面定植并增强细菌与宿主相互作用的机制。随着时间的推移,对强毒株的详细研究使得各种影响因素为人所知,这些因素使Mh和Pm在逃避宿主免疫反应或增强临床疾病方面没有差异(表1)[5]。这种能力是很重要的,因为了解致病的不同毒力因子可能有助于开发出以增强对这些化合物的免疫力为中心的控制策略。
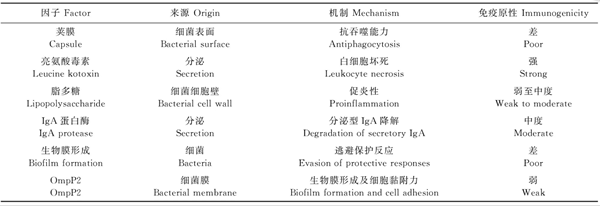
表1 溶血性曼氏杆菌和多杀性巴氏杆菌的免疫逃避机制和毒力因子
Mh和Pm都能产生一系列黏附素,这些黏附素允许上皮细胞附着并防止吞噬作用[5]。例如,荚膜 A型Pm的荚膜由透明质酸组成,这种荚膜增强了与呼吸道上皮细胞的结合和在下呼吸道的定植。此外,Mh产生一种纤维蛋白原结合蛋白,该蛋白包裹在细菌细胞表面,阻止补体结合,从而降低调理作用[5]。值得注意的是,这些病原微生物的其他血清型的荚膜是由与宿主组织成分非常相似的物质(如肝素、软骨素)组成的,这可能导致它们的抗原性较差。
这些病原体还有其他几种逃避和操纵宿主免疫系统的方法。例如,免疫球蛋白(Ig)A-特异性蛋白酶系列可以裂解IgA并阻止其与病原体结合[11]。这些蛋白酶的最终作用是防止调理作用或补体介导的杀伤。此外,Mh具有在呼吸道中形成生物膜的能力,生物膜是一种由多糖、蛋白质和DNA组成的聚合物包裹的有组织的细菌群落,是细菌适应生活在潜在的恶劣环境中的一种手段[11]。在健康的宿主中,大多数Mh可能存在于口咽和扁桃体隐窝的生物膜中。在生物膜内,细菌可以免受抗菌药物和宿主免疫反应的影响。当病原微生物处于生物膜而非浮游状态时,许多抗菌药物对Mh的最低抑菌浓度(minimum inhibitory concentration,MIC)倍增[12]。此外,研究表明,宿主产生的应激性化学物质(P物质、去甲肾上腺素、肾上腺素)可以促进生物膜扩散,生物膜是一种能够从上呼吸道向下呼吸道运动的因子,并将应激与临床BRD联系起来[13]。
白细胞毒素是一种由Mh产生的与临床疾病相关的重要毒力因子,这种毒素的重要性与Mh致病性直接相关。因此,在设计Mh的控制方案时,必须首先考虑白细胞毒素的影响。白细胞毒素是毒素(repeat in toxin,RTX)家族中的重复序列,在细菌的对数生长期所有Mh均可产生[6]。白细胞毒素可特异性地与牛中性粒细胞、巨噬细胞、血小板和淋巴细胞表面的分化簇(cluster of differentiation,CD)18相互作用,一旦与之接触,中性粒细胞就会脱颗粒并释放有效的消化酶进入周围组织。此外,白细胞毒素刺激组织肥大细胞的脱颗粒和血管活性介质的释放。如前所述,内毒素和白细胞毒素具有协同作用,内毒素是一种有效的趋化剂,可使中性粒细胞和其他炎症细胞进入呼吸道。此外,内毒素的释放有助于CD18在炎性细胞表面的上调表达。因此,更多的细胞对白细胞毒素具有更高亲和力,其存在可导致严重的临床疾病发生[5],如Mh经常与典型的纤维蛋白性胸膜肺炎的发生相关。
3 Mh与Pm的耐药性
兽医最关心的是细菌的临床抗药性,他们感兴趣的是某种特定抗菌药物能有效治疗被某种特定病原体感染而导致某种疾病的动物[14]。临床耐药的概念是基于临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)——兽医抗菌药物敏感性测试委员会制定的药敏结果解释标准,具体如下:一是特定细菌病原体代表性群体的抗菌药物的体外最小抑菌浓度(minimum inhibitory concentration,MIC)范围;二是通过药物浓度与微生物敏感性之间的关系,建立的药代动力学/药效学(PK/PD)的参数;三是在目标物种中进行临床试验的结果[15]。
对于BRD病原体,CLSI批准了针对青霉素(仅限于肉汤稀释法)、头孢噻呋、达氟沙星(danofloxacin)、恩诺沙星、氟苯尼考、硫酸大观霉素、拖拉霉素(tulathromycin)、加米霉素(gamithromycin)、泰地罗新(tildipirosin)和替米考星(tilmicosin)的药敏结果解释标准[16];对于这些抗菌药物,敏感性结果表明治疗成功的可能性明显大于耐药性结果。这些药敏结果仅适用于按照抗菌药物使用说明进行,且药敏试验采用CLSI批准的方法和解释标准的情况下,然而药敏试验与临床结果之间的关系并不完善。同样有一点非常重要,我们必须认识到抗菌药物药敏试验不能保证在单个动物身上得到特定的临床结果。试图通过体外测试获得的药敏结果来推断体内反应,疾病结果通常受到诸如宿主免疫状态、个体药代动力学参数变化或疾病严重程度增加/病程延长等因素的影响。对于没有CLSI批准的药敏结果解释标准的抗菌药物,已从其他物种的血浆和组织液中推断获得,例如青霉素G(纸片扩散法)、四环素(纸片扩散法)、强化磺胺类药物、氨基糖苷类药物和红霉素等药物[17]。对于这些抗菌药物而言敏感结果优于耐药性结果,但是目前尚无相关数据可将敏感性测试结果与牛BRD的预期结果相关联。
第二种耐药性是根据监测细菌野生型种群中药物敏感性分布特征变化的数据进行定义的[18]。这些流行病学临界值没有提供与临床结果相关的数据,而是代表了MIC与原始细菌种群的偏差,可以用来指示耐药性决定因素的出现。因此,流行病学临界值可能表明MIC的耐药性与临床药敏结果解释标准有所不同(通常更低)。此外,尽管文中提到的许多研究可能涉及多种抗菌药物,但仅讨论CLSI已建立敏感性结果解释标准的药物;病原体为Mh、Pm和睡眠嗜血杆菌(Histopilussomni,Hs),抗菌药物为头孢噻呋、达氟沙星、恩诺沙星、氟苯尼考、加米霉素、青霉素、大观霉素、四环素、泰地罗新、拖拉菌素、替米考星(仅适用于Mh)。
4 Mh与Pm的流行率与耐药模式
最早建立的Mh与Pm的MIC分布是利用现代实验室诊断方法和CLSI批准的药敏结果解释标准,通过对1988年至1992年期间死于BRD的动物调查得出的[19];在这项研究中,对美国和加拿大20多个州的461株Mh和318株Pm菌株进行MIC测定,结果表明Mh和Pm分离菌株100%对头孢噻呋敏感,83.5%和83.3%对大观霉素敏感,57% 和70.5%对四环素敏感,69.1%和未测试对替米考星敏感。值得注意的是,研究中使用的替米考星的解释标准在Mh与Pm上均未通过验证;按照目前公认的标准,使用该药物的耐药性将显著降低(>90%敏感)。对1994年至2002年俄克拉荷马州死于BRD的肉牛肺中分离获得的390株Mh和292株Pm耐药性进行研究,结果表明四环素和大观霉素的敏感性各不相同且较低,氟苯尼考和替米考星与头孢噻呋和恩诺沙星的结果正好相反,敏感性很高且相对稳定[20]。对2000年至2009年间美国和加拿大收集的Mh(n=2 977)和Pm(n=3 291)分离株进行药物敏感性评估,结果显示头孢噻呋对两种病原体均保持高度敏感且一致(100%敏感),对达氟沙星、恩诺沙星和氟苯尼考的敏感性随时间的推移保持稳定,而对替米考星和拖拉菌素的敏感性均下降[21]。一项来自堪萨斯州立大学的对细菌多重耐药性和共同耐药模式的研究,被认为具有里程碑意义,该研究评估了2009年至2011年期间从患有BRD的牛肺部分离的Mh分离菌株;研究结果表明分离株对5种或5种以上抗菌药物的耐药性比例从5%增加到35%,对土霉素或替米考星耐药的菌株,至少对另外1种抗菌药物的耐药性明显更高[22]。
研究人员对到达和离开育肥场的牛就抗菌药物的耐药性进行了多项研究。Klima C L等[23]对阿尔伯塔省南部2个饲养场,在进入时和离开前30 d内选取30%圈舍采集10%的动物鼻拭子样本,用于Mh的分离和药敏试验,获得了409株Mh,药敏结果显示对所有抗菌药物的耐药性从0.2%到3.9%不等且都很低,其中对土霉素普遍耐药;值得注意的是,该研究中许多被评估的抗菌药物,CLSI没有明确由Mh引起的BRD的药敏结果解释标准,这使得研究中的一些结论难以解释。Noyes N R等[16]对加拿大4个饲养场按照到达时和离开前的一个时间点,采集深部鼻咽(deep nasopharyngeal,DNP)拭子,获得2 989株Mh,评估21种不同抗菌药物的敏感性,耐药性很少见,87%的菌株对所有抗菌药物都敏感。值得注意的是该研究与Klima的相似,许多被评估的抗菌药物, CLSI没有解释标准。一项来自加拿大的研究评估了从健康和患有BRD的牛身上分离出Mh的耐药模式, 18%的分离菌株具有耐药性[17]。总的来说,收集于BRD牛的分离株(32%)比健康牛 (2%)更容易产生耐药性。分离菌株普遍对四环素耐药,一般来说,如果分离株对一种药物耐药,它也至少对一种其他的抗菌药物耐药[17]。
Snyder E等[7]评估了使用长效大环内酯类药物拖拉霉素预防Mh耐药性的流行情况,取得了令人惊讶的结果。犊牛在进入育肥场之前被给予拖拉霉素以防止BRD发生,在抵达当天采集DNP拭子,10 d~14 d后再采集1次。结果表明与在抵达时相比,对于除头孢噻呋外的所有抗菌药物,第二次被划分为中介或耐药的分离株比例显著增加。第二次药敏结果显示0.8%表现为敏感, 24.4%对2种抗菌药物(氟喹诺酮类和大环内酯类)中介或耐药, 74.8%对3种抗菌药物(氟喹诺酮类和大环内酯类以及酚类或头孢菌素类)表现为中介或耐药[7]。评估恩诺沙星和拖拉菌素在治疗和预防犊牛BRD中的疗效和耐药性时得出了与Snyder类似的结果。Woolums A R等[18]进行的相关研究也得出了类似的结果,使用大剂量泰地罗新进行药物治疗后采集DNP拭子,分离鉴定的Mh分离株几乎对除头孢噻呋外的所有药物均具有耐药性,且100%属于多重耐药(multidrug resistance,MDR)。
综上所述,许多有关BRD主要细菌性病原体耐药性的研究工作都来自饲养场和育肥场。而在养殖场中,关于耐药性的研究相对较少。来自瑞士的Pipoz F等[19]收集了来自52个奶牛群的中犊牛临床样本,对样本中Mh和Pm分离菌株的耐药流行情况进行了研究。结果表明Mh(n=8)分离菌株对四环素、恩诺沙星、青霉素、头孢噻呋、大观霉素和氟苯尼考敏感;相比之下,Pm(n=37)分离菌株对恩诺沙星、头孢噻呋、大观霉素和氟苯尼考敏感,但对替米考星呈现中介,对四环素呈现耐药。Owen J R等[20]评估了美国加利福尼亚的一个育肥场和饲养场采集的犊牛鼻拭子中分离出的Mh和Pm菌株耐药性的流行情况,结果显示Mh和Pm分离株对头孢噻呋和恩诺沙星敏感,其中大多数Pm分离株对青霉素和托拉菌素敏感,超过50%对达氟沙星耐药,30%对氟苯尼考耐药,90%以上的对四环素和替米考星耐药;所有的Mh分离株均对大观霉素敏感,20%对达氟沙星、拖拉菌素和氟苯尼考耐药,30%对替米考星耐药,有60%对青霉素耐药。一项来自Snyder E等[5]的最新研究,收集了加利福尼亚一个牧场的100头诊断为BRD的奶牛样本(经鼻腔清洗、支气管肺泡灌洗液的DNP拭子),对样本中分离的Mh(n=53)和Pm(n=175) 进行了药物敏感性评估,结果显示多数Pm(>90%)分离菌株对氨苄西林、头孢噻呋、青霉素、大观霉素和托拉菌素敏感,但对恩诺沙星和氟苯尼考耐药;相比之下,大多数Mh (>90%)对氨苄西林、头孢噻呋、青霉素和氟苯尼考敏感,对恩诺沙星和大观霉素中介,对拖拉菌素耐药。
5 多重耐药的遗传机制
上述表明BRD是主要细菌性病原体,特别是Mh的耐药性正在增加,广泛耐药(extensively drug-resistant,XDR)Mh的分离也越来越普通。所以,问题是只接触一种药物后,如何产生对多种抗菌药物的耐药性?通常是水平基因转移导致了抗药性的迅速增加。水平基因转移有3种不同的方式:(1)通过转化从环境中所谓的外源DNA中获取基因;(2)通过转导由噬菌体转移遗传物质;(3)通过获取可移动的遗传元素[21-22]。虽然这3种机制都可以在获得耐药性中发挥作用,但在Mh和Pm中,多重耐药(multidrug resistance,MDR)菌株增加的主要驱动因素似乎是获得一种称为整合共轭因子(integrative conjugative element,ICE)的移动遗传元件[23]。ICE是整合到宿主染色体中的移动遗传元件,然后可以将它们繁殖并传给后代,但也可以自我切割,以环状中间体的形式复制,并通过Ⅳ型分泌系统转移到其他邻近细胞,最终整合到新宿主的染色体中[22]。ICE中通常还带有其他载体基因包括抗药性基因,受体细胞正是随着ICE转移的这种方式迅速获得了多种抗药性基因[24]。
Mh和其他与BRD相关的巴氏杆菌科中已记录了大量不同的ICEs。Pm(ICE-Pmu1)中鉴定出第一个携带四环素、氟苯尼考、磺酰胺、大观霉素、恩诺沙星、替米考星和拖拉霉素抗性的ICE基因。 Eidam C等[25]在Mh 菌株42548中发现鉴定出第一个ICE基因是ICEMh1,该ICE基因比ICEPmu1长但缺少一些基因,这些基因赋予了ICEPmu1对相同数量的抗药性基因。
2014年Klima C L等[23]对来自Mh、Pm和Hs的25个ICEs进行了鉴定。在采集自乔治亚州肉牛育肥场的Mh分离菌株中发现了3个ICEs(命名为UGA1,UGA2,UGA3),这些ICEs的长度各不相同,但与ICEMh1和ICEPmu1具有同源性;ICEMh-UGA1和ICEMhUGA2的前1/4与ICEMh1相似,而其余3/4与ICEPmu1相似。此外,这些ICEs携带的所有抗性基因与存在于ICEPmu1中的相同,但ICEMh-UGA2中不含有floR基因(对氯霉素类药物具有抗性的基因);与鉴定出的其他两种ICE不同,ICEMh-UGA3仅携带tetH/R抗性基因复合体(该复合体编码对四环素类抗生素的抗性基因)。
ICEs中存在的耐药基因将对多种类型、具有抗菌作用的大量抗菌药物产生抗性。在Mh分离株携带的β-内酰胺抗性基因中,最常见的是blaOXA-2,其次是blaROB-1(尽管该基因携带在不依赖于ICE的质粒上的可能性较大,就像最近发现的blaROB-2基因)[8,23,26-27]。所有这些编码超广谱β-内酰胺酶的基因,不仅对经典的青霉素类药物,而且对较新的广谱头孢菌素类药物都具有抗性[27]。已知所有这些基因均可传递对氨苄青霉素和青霉素的耐药性,并可能增加头孢噻呋的MIC[23,28]。不过,这些基因的存在可能不会自动导致抗性,因为已知这些基因会产生导致基因失活的点突变[29]。
Mh和Pm对氯霉素类抗生素的耐药性通常是由floR基因的存在引起的[23]。该基因编码一种药物外排转运蛋白,它能主动地将氯霉素类抗生素泵出细胞。然而在某些情况下,floR并不能使Mh和Pm产生完全的抗性而是将MIC调整到中间范围,这可能是因为这些微生物中基因的活性降低。tet类基因是编码四环素的最常见抗性基因,这些基因可调控外排泵将四环素主动泵出细菌细胞。在Mh和Pm中,tetH、tetB、tetL和tetG是编码这种泵的最常见基因,它们可以在质粒和细菌染色体中找到[30]。但是在Mh和Pm的ICEs中仅发现并记录了tetH基因[23,25]。在这些ICEs中通常还存在一个tetR基因(有时是重复的),它充当tet基因对四环素浓度敏感的转录调节因子[23,25,31]。
大环内酯类药物广泛应用处于高风险的BRD牛身上[32]。erm42、msrE和mphE基因是Mh和Pm ICE中最常见的大环内酯类耐药基因,它们以不同的方式对这类抗菌药物产生耐药性。研究表明erm42基因编码一个单甲基转移酶,该转移酶在23S核糖体亚基上的A2058核苷酸处添加了一个甲基基团,从而导致对林可酰胺类药物的耐药性,以及对低浓度大环内酯类和链霉素类抗生素具有耐药性。msrE基因编码大环内酯类外排泵,对14元和15元环大环内酯类药物如红霉素、拖拉菌素和加米霉素产生耐药性;然而,它不产生对16元环大环内酯类药物的耐药性,如泰乐菌素、替米考星和泰地罗新。mphE基因是一种大环内酯类磷酸转移酶,在传递抗菌药物耐药性的方面与msrE具有相似的作用机制。随着时间的推移,磺胺类药物在治疗牛病上的疗效逐渐下降,伴随着新抗菌药物的出现其使用量越来越少。sul1和sul2基因是革兰氏阴性菌对磺胺类药物的主要耐药基因,它们是通过编码一种耐药的二氢叶酸合成酶来起作用的。到目前为止,在Mh和Pm中仅发现sul2基因和ICE相关。ICE中存在的其他基因有aadA25、aadB、strA和strB以及aphA1,这些基因编码对氨基糖苷类抗生素的抗性。aadA25(ant3〃)通过编码氨基糖苷类O-核苷酸转移酶促进对氨基糖苷大观霉素和氨基糖苷链霉素的耐药性。aadB(ant2〃)也编码氨基糖苷O-核苷酸转移酶,但对庆大霉素、妥布霉素、地贝卡星(Dibekacin)、西索米星(Sisomicin)和卡那霉素产生耐药性。strA(aph3〃)、strB(aph6)和aphA1(aph3′)是抗性基因,其编码修饰和使氨基糖苷失活的氨基糖苷O-磷酸转移酶。strA和strB均对链霉素产生耐药性,而aphA1则对卡那霉素、新霉素、巴龙霉素(paromomycin)、核糖霉素和利维霉素(lividomycin)产生耐药性。
导致Mh分离菌株XDR株流行率上升的因素可能是携带多种基因,这些基因对目前用于预防和治疗BRD的大多数抗菌药物产生耐药性。重要的是由于牛呼吸道病原体具有XDR的性质,接触一种抗菌药物不再仅仅是选择对这一种抗菌药物的耐药性。耐药性现在是一种多药现象,接触一种抗菌药物中会选择对其他多种相关和不相关的抗菌药物产生耐药性。关于BRD病原体耐药性的另一个重要因素,就是耐药性的增加很大程度上是由众多MhXDR菌株所携带的ICE导致的[8]。抗菌药物导致XDR菌株的扩增和繁殖,以及随后该菌株基因组中携带的所有基因和突变。因此,如果动物被诊断出患有BRD并接受了一种特定的抗菌药物治疗,那么该动物随后不仅会携带对该抗菌药物具有耐药性的分离株,而且会对该动物分离株ICE所携带的其他所有抗菌药物具有抗性,因为不同的基因之间存在联系[7,9]。此外,由于XDR Mh菌株也含有对氟喹诺酮类抗菌药物产生耐药性的突变,尽管该基因/突变未携带在ICE上,但对此类抗菌药物的仍将呈现耐药表型[8,18]。重要的是,有新的证据表明这些菌株可能通过牛犊之间的接触以及暴露于受污染的环境,在具有感染风险的牛群中传播[8-9,16]。因此,了解XDR,重要的是不要仅仅局限于治疗过的动物;相反,有可能会在与治疗动物使用但从未接触过抗菌药物的动物身上发现XDR克隆[16]。
6 抗菌药物耐药性对治疗结果的影响
首次治疗成功的定义是在第一次应用抗菌药物治疗效果显著的动物比例。在大多数育肥牛饲养场中首次治疗成功的比例都很高。通常,大于80%的首次治疗成功比例被认为是可以接受的。但是,Avra T D等[33]对引起治疗失败的风险因素进行评估和回顾性研究发现,超过30%的牛对首次治疗没有反应,而且暴露于高风险感染状态比低风险状态的犊牛首次治疗失败的可能性大。但是关于耐药性对患BRD牛临床预后的影响很少有人评估,Mcclary研究表明处于易受Mh分离株感染中的牛群 62%(n=688)对替米考星治疗有反应,但是38%(n=6)的牛携带耐药菌株。
7 结语
在临床治疗中必须认识到毒力因子和抗菌药物耐药性,并在制定以这些病原微生物为中心的治疗和控制方案时考虑这些因素。尽管BRD对北美乃至世界养牛业具有重要意义,养牛业发达国家包括我国在内的研究人员很少有经过精心设计的研究来评估引起BRD重要细菌性病原体的抗药性。现在发表的多数文献均是来自于经过多次不同抗菌药物治疗的病死牛样本中获得实验诊断报告,且这些动物已经用多种不同的抗菌药物进行了多次治疗。以Mh为例,总体趋势表明,随着时间的推移敏感性降低了,临床耐药菌株在逐渐增加。近年的研究表明,某些牛场中常见的抗菌药物使用方法可能是促使耐药克隆增加的主要因素。在科研人员做好流行病学、病原分离鉴定、致病机理、耐药性与免疫防控研究的基础上,广大从事具体养殖的牧场主和从业人员,应将重点放在养殖场生物安全防控、减少应激、增强免疫功能和抗菌药物管理上,将有助于成功控制由这些微生物引起的疾病综合征,减少由此产生的负面影响和经济损失,促进养殖健康可持续发展。
动物医学论文范文 第14篇
题目:猪流行性腹泻病毒入胞机制研究现状
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)属于套式病毒目(Nidovirales)、冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus)α冠状病毒(Alphacoronavirus)。该病毒主要感染猪肠道上皮,导致绒毛萎缩、吸收不良,引起新生仔猪急性腹泻、呕吐、脱水和高病死率。PEDV主要通过粪-口直接接触传播,也可形成气溶胶并通过粪-鼻途径传播[1]。
猪流行性腹泻在20世纪70年代后期首次出现在英国和比利时[2]。我国于1973年首次报道猪流行性腹泻病例;随后,包括韩国和日本在内的其他亚洲国家也相继暴发该病[2]。2010年10月之后我国开始大规模暴发该病[2]。目前,PEDV已成为亚洲仔猪腹泻的主要原因,是世界上最严重的猪病毒性疾病之一,给生猪行业的发展产生了巨大影响,造成了重大经济损失。
本文主要针对国内外近期在PEDV的组织和细胞嗜性、细胞受体、入胞方式、细胞蛋白酶方面的研究进展进行综述,以期为后续PEDV的研究提供参考。
1 PEDV的组织和细胞嗜性
病毒在特异组织和细胞中的复制能力是决定其组织嗜性的重要因素。PEDV在肠道具有组织嗜性,哺乳猪感染急性PEDV的12 h~24 h内,PEDV主要感染空肠和回肠,其次是空肠近端和十二指肠[3]。幽门不是急性PEDV感染的部位,而大肠的绒毛肠细胞经常被感染,但感染的结肠上皮细胞无坏死病变。与结肠肠上皮细胞不同的是,PEDV感染的小肠绒毛肠上皮细胞会发生急性坏死并从固有层剥落,导致小肠中明显的绒毛萎缩或融合[1]。PEDV可能不会在体内诱导肠道绒毛肠细胞凋亡,但体外感染PEDV的非洲绿猴肾细胞(Vero细胞)会发生凋亡[1]。
PEDV感染早期定位在小肠的绒毛-隐窝界面,而不是在绒毛尖端中。PEDV最先感染未成熟的肠细胞,随后感染至空肠上部,直至感染整个空肠的绒毛上皮[1]。除了通过粪-口传播,PEDV还能够经过鼻腔黏膜下的树突状细胞的摄取进入鼻腔黏膜固有层,随后摄取PEDV后的树突状细胞迁移至附近淋巴结,通过病毒突触将PEDV传递给淋巴细胞,而后携带PEDV的淋巴细胞又能经淋巴循环和血液循环迁移至肠黏膜,并将病毒传递给肠上皮细胞引起致病[3]。PEDV在体内除主要感染猪小肠上皮细胞外,还感染杯状细胞和隐窝干细胞[4],也能够在仔猪鼻腔上皮中进行低水平复制[3]。
PEDV的S蛋白既具有受体结合能力又具有膜融合能力,S蛋白是决定组织和细胞嗜性以及宿主范围的关键因素,但PEDV的细胞适应性差。自PEDV发现以来,科研人员尝试了很多方法将病毒适应于细胞培养。1984年宣华等首次报道了在胎猪肠组织单层细胞上培养PEDV,但因胎猪肠组织不易获得,未得到广泛应用。直到1988年,Hofmann等通过向Vero细胞培养基中添加胰蛋白酶,使PEDV成功适应于Vero细胞。其后,日本和韩国也相继报道PEDV在Vero细胞上培养成功。我国李树根、钱永清等也成功地在体外实现PEDV的细胞培养。
目前PEDV的分离培养多数需要在细胞培养基中添加胰蛋白酶,可能是由于蛋白酶在PEDV侵入细胞和细胞释放PEDV病毒粒子方面起着重要作用。但是,不同来源的PEDV或Vero细胞适应株对胰酶的抵抗力不一致,有的病毒经过高代次传代培养后已不具备胰酶依赖性。研究发现,胰蛋白酶通过将S蛋白切割为S1和S2亚基,使PEDV能够在体外复制[5]。胰酶识别切割S蛋白的裂解位点在S2区的890位氨基酸,裂解后的S2可以促进病毒与宿主细胞膜融合,利于病毒粒子的入侵[6]。随后,PEDV可使受感染细胞裂解,导致细胞膜空泡化和合胞体形成[7]。
适应Vero细胞的PEDV可以在不同种类的细胞系中增殖。Liu等将仔猪中分离的PEDV Ohi VBS2株在Vero CCL-81细胞中进行适应性培养,随后用该细胞适应的PEDV分别感染PK-15、猪睾丸细胞(swine testicle,ST)、人肝癌细胞(human hepatocellular carcinomas,Huh-7)、人胚肺成纤维细胞(human embryonic lung fibroblasts,MRC-5)、Vero CCL-81和蝙蝠肺细胞(bat lung,Tb1-Lu)等,结果发现Vero CCL-81细胞适应的PEDV可以感染上述细胞系,提示PEDV能够感染猪源、猴源、人源及蝙蝠源的细胞系[8]。结合基因组进化分析结果,推测PEDV可能来源于蝙蝠并且对包括人在内的其他物种都有潜在的感染能力[8]。为探索新的培养方法,研究人员利用仔猪小肠上皮细胞(intestinal epithelial cell,IEC)成功分离了PEDV流行株,通过与Vero细胞对比发现病毒在添加胰酶的IEC上适应细胞能力更强,并可以稳定传代[9]。推测可能是由于仔猪小肠上皮细胞是PEDV感染的宿主细胞,含有大量PEDV结合受体,例如pAPN等[10]。此外,IEC上的小肠宿主蛋白酶,可能具有类似胰酶的特性,可以促进病毒的侵入和增殖,提高PEDV体外培养的适应性。
2 PEDV的受体
病毒通过吸附、侵入、脱壳、合成、装配、释放等环节完成增殖,病毒黏附到细胞膜上是侵入宿主细胞的第一步,一般是与细胞表面的特异性受体结合。冠状病毒的受体包括多糖类受体和蛋白多肽类受体,其中多糖类受体又包括硫酸乙酰肝素和唾液酸。唾液酸有神经氨酸 Neu5Gc、Neu5Ac、Neu5、9Ac2等;蛋白多肽受体有氨基肽酶N (aminopeptidase N,APN)、血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)、癌胚抗原相关细胞黏附分子-1(carcinoembryonic antigen-associated adhesion molecule 1, CEACAM1)和二肽酰肽酶4(dipetidyl peptidase 4,DPP4)等[11]。研究发现,APN可能是PEDV的功能受体[8,10],而Neu5Ac作为辅助受体发挥作用[8]。
氨基肽酶N(APN)是一种海马型锌-氨基肽酶,具有锌离子依赖性,以头对头的同源二聚体形式锚定于细胞表面。APN的活性位点和肽结合通道位于一宽开口的腔中,空腔可能会进一步开放,以结合暴露的蛋白质N末端。活性位点锚定在肽/蛋白质的N-末端中性残基,并且肽结合通道以不依赖序列的方式结合其余的肽/蛋白质。APN暴露的外表面可与冠状病毒结合,但不会影响其生理功能,从而充当冠状病毒受体。哺乳动物的APN多表达于肠上皮或神经系统等组织的细胞表面,是一种具有多种功能的二聚体细胞表面胞外酶。
关于猪源APN(porcine aminopeptidase N,pAPN)是否为PEDV的受体,一直存在争议。Li B X等[10]利用PEDV分别感染非易感细胞犬肾细胞(Madin-Daby canine kidney cells,MDCK)和过表达pAPN的MDCK细胞,发现PEDV能够在pAPN过表达的MDCK细胞生长,初步确定pAPN为PEDV的功能性受体。此外,通过建立表达pAPN的转基因小鼠模型,发现其对PEDV易感,进一步证明pAPN为PEDV的受体[12]。但是PEDV无法在天然表达pAPN的ST细胞中复制,而后者却对TGEV非常敏感。因此,有人推测认为,pAPN表达水平与PEDV感染之间可能存在相关性。进一步研究表明,pAPN受体密度似乎是导致PEDV感染成功的重要因素[13]。Liu C等[8]利用PEDV S蛋白假病毒系统发现,该假病毒能感染表达人源APN(hAPN)或pAPN的非易感细胞MDCK,表明PEDV与APN的相互作用不具有物种特异性。而且,PEDV能感染猪、猴、人、蝙蝠等物种的细胞系[8],也进一步表明PEDV与APN的相互作用并不是特异的,提示PEDV可以跨物种传播。
近年研究发现,hAPN和pAPN可能不是PEDV的主要功能受体,APN可能通过其蛋白酶活性促进PEDV感染,但PEDV感染猪小肠上皮细胞可能与pAPN不相关[7,14]。另外,PEDV可以感染Vero细胞,但Vero细胞上的PEDV受体需要进一步确认。Ji C M等利用CRISPR/Cas9技术敲除Vero细胞的APN基因后,发现APN敲除的细胞系与正常的Vero细胞感染效率相同,而且构建的稳定表达绿猴APN的Vero细胞系感染PEDV的效率也未见增加,表明Vero细胞上可能存在其他类型的PEDV受体[7]。使用肝素作为竞争剂,发现肝素预处理PEDV时,可有效地抑制PEDV感染Vero细胞的效果,推测硫酸乙酰肝素可能是PEDV感染Vero的黏附因子,也可能是Vero细胞对PEDV易感的原因之一。此外,Vero细胞本身是干扰素缺陷型细胞且具有抗高浓度胰酶的特性,也可能是PEDV易感的另一个原因,这也进一步提示pAPN不是PEDV的唯一受体。因此,PEDV可能通过不同受体感染宿主细胞。
唾液酸是带负电荷单糖,普遍存在于细胞膜表面,唾液酸有很多病毒结合糖蛋白和糖脂的唾液酸寡糖,由于细胞外表面上糖链中唾液酸分子的介导使病毒进入细胞。除了APN,有研究表明PEDV S1的N末端具有唾液酸结合活性,S1 NTD与细胞表面的唾液酸结合能增强病毒的感染性[15]。通过聚糖阵列筛选,发现Neu5Ac与PEDV S1的结合亲和力最高[16]。然而,尚不知道唾液酸与S蛋白的结合如何影响PEDV进入细胞。
3 PEDV入胞方式
多数病毒的表面蛋白能够特异性地识别和结合细胞膜表面的受体,进而介导病毒的入胞[11]。有囊膜的病毒能直接与细胞膜发生膜融合,进而将病毒基因组释放到宿主细胞质中;多数囊膜病毒是通过宿主细胞的内吞作用,将病毒颗粒包裹在内吞小体中并进入细胞。在内吞小体中,病毒囊膜与内吞小体的膜结构在蛋白酶和低pH环境下发生病毒囊膜-内体膜融合,使病毒基因组释放到宿主细胞质中。病毒利用的内吞途径包括网格蛋白介导的内吞、小窝蛋白介导的内吞、脂筏介导的内吞和巨胞饮作用等。
2014年,Park J E等[17]利用化学抑制剂和共聚焦方法分析了PEDV侵入Vero细胞的机制,发现PEDV的入胞过程是在网格蛋白介导的内吞作用之后发生的,并且依赖于低pH才能成功进入细胞。Wei X N等[18]用不同的PEDV亚型(PEDV GⅠ亚型GDS09株和GⅡ亚型GDS01株)分别感染Vero和IPEC-J2细胞,发现PEDV可以通过网格蛋白介导的内吞、小窝蛋白介导的内吞和脂筏介导的内吞途径进入Vero和IPEC-J2细胞,而且不同亚型PEDV的侵入效率因内吞途径不同而不同。进一步分析发现,不同PEDV亚型之间的差异可能是由于S基因的差异,尤其是S基因的S1区(同源性约为92 %)与受体结合效率的不同而导致细胞进入和膜融合效率的不同[19],提示PEDV的刺突蛋白在介导不同方式的内吞途径中各有重要作用。进一步研究发现,PEDV主要通过内吞途径进入内吞小体,在低pH环境和组织蛋白酶L的水解作用下引发病毒表面蛋白构象的改变,从而发生病毒囊膜-内体膜融合以及病毒脱衣壳,释放病毒基因组进入细胞质[19]。
关于PEDV侵入细胞的途径,就目前研究结果来看,可能与猪德尔塔冠状病毒的入侵方式类似[20]。一是内吞途径,通过宿主细胞的内吞作用,将病毒颗粒包裹在内吞小体中并进入细胞。在内吞小体中,病毒囊膜与内吞小体的膜结构在组织蛋白酶L、低pH环境下进行融合,使病毒基因组释放到宿主细胞质中[19]。二是膜融合途径,通过外源蛋白酶或宿主蛋白酶在病毒和受体结合后激活S蛋白,然后病毒通过膜融合方式进入细胞质中。
4 蛋白酶在PEDV感染中的作用
蛋白酶在病毒感染中起关键作用,不同的病毒与不同的蛋白酶相互作用从而进入细胞,这在某种程度上决定了病毒的侵入途径。一般来说,主要有4种细胞蛋白酶参与冠状病毒的感染过程。
4.1 膜结合蛋白酶
大量研究表明,跨膜丝氨酸蛋白酶在病毒与细胞受体结合后介导病毒侵入。丝氨酸蛋白酶可以激活很多呼吸道冠状病毒的感染过程。Shirato K等发现跨膜丝氨酸蛋白酶2(transmembrane protease serine 2,TMPRSS2)可以显著促进PEDV在稳定表达TMPRSS2的Vero细胞中释放病毒粒子[21]。Shi W等[22]通过对Ⅱ型跨膜丝氨酸蛋白酶家族的TMPSS2、鳞癌细胞差异表达蛋白酶1(differentially expressed squamous cell carcinoma gene 1,DESC1)、呼吸道胰酶样蛋白酶(human airway trypsin-like protease,HAT)和镶嵌式长型丝氨酸蛋白酶(mosaic serine protease large-form,MSPL)蛋白酶进行分析,结果发现TMPSS2和MSPL可与PEDV S蛋白进行共定位,且这些蛋白酶可以裂解S蛋白、促进病毒与细胞的融合。Shi等分别建立了稳定表达TMPRSS2和MSPL的Vero/TMPRSS2和Vero/MSPL细胞系,结果发现这两种细胞系(尤其是Vero/MSPL)可以代替外源胰蛋白酶用于体外培养PEDV,它们通过激活PEDV S蛋白可以显著提高病毒滴度,促进病毒-细胞之间的融合[23]。
4.2 组织蛋白酶
病毒与细胞融合进入内吞体后,溶酶体组织蛋白酶L或组织蛋白酶B即可激活病毒侵入。组织蛋白酶对SARS-CoV-2、MERS、HCoV-229E、SARS等冠状病毒均有激活作用[24-26]。利用PEDV S蛋白假病毒系统发现,PEDV侵入细胞并不依赖于前蛋白转化酶或细胞表面蛋白酶,而是被溶酶体半胱氨酸蛋白酶(组织蛋白酶L和组织蛋白酶B)激活从而裂解S蛋白,促进S蛋白包装的假病毒粒子侵入宿主细胞[27]。同时,组织蛋白酶激活PEDV侵入的效果优于胰蛋白酶,而当组织蛋白酶被抑制或缺少时,胰蛋白酶则可以替代组织蛋白酶的作用,激活PEDV侵入[27]。
4.3 细胞外蛋白酶
胰蛋白酶是一种消化酶,主要分布在小肠中,可直接裂解许多肠道冠状病毒的S蛋白,因此,对PEDV侵入具有一定的促进作用。研究发现,大多数PEDV毒株都高度依赖胰蛋白酶。当病毒与其受体结合时,胰蛋白酶可切割结合的PEDV S蛋白,而游离病毒颗粒不会被裂解[28]。这些发现表明,PEDV S蛋白在与受体结合并被外源胰蛋白酶切割后可能发生构象变化,从而诱导膜融合[28]。有研究表明,胰蛋白酶识别S蛋白的裂解位点为S2区的890位氨基酸,S蛋白的裂解可以促进病毒与宿主细胞膜融合,利于病毒粒子的入侵[6]。但是一些PEDV的Vero细胞适应株在感染细胞时并不需要胰蛋白酶,而病毒出芽阶段经胰蛋白酶处理可在感染的细胞中引起明显的细胞病变作用,导致感染的Vero细胞形成合胞体,在此过程中胰蛋白酶可以增强其感染性和CPE的形成[28-30]。
4.4 前蛋白转化酶
弗林蛋白酶(Furin)是一种前蛋白转化酶,位于反式高尔基体网络(Trans Golgi Network,TGN)中,也存在于细胞表面。弗林蛋白酶可以裂解具有特定基序的前体蛋白,以产生具有生物学活性的成熟蛋白。该酶可以在PEDV的S1/S2位点上切割S蛋白,这种切割对于S蛋白介导的细胞-细胞融合和宿主细胞入侵至关重要。研究人员通过将PEDV S蛋白中的第888位氨基酸(V888)突变为弗林蛋白酶识别的裂解位点(VQKR→RQKR),构建融合肽N端带有弗林蛋白酶切割位点的重组PEDV毒株PEDV-SFCS,结果发现PEDV-SFCS可在培养细胞中复制,且不依赖胰蛋白酶,但是重组病毒的滴度较低[31]。表明宿主蛋白酶可能具有替代胰蛋白酶的潜力,如果能合理利用可以使得PEDV体外培养无需胰蛋白酶。
5 展望
PEDV刺突蛋白S决定了病毒的多样性和宿主嗜性,并介导病毒与宿主细胞的表面特异性受体结合和病毒-细胞膜融合过程;S蛋白还与PEDV的体外生长适应情况和体内毒力衰减有关。随着PEDV突变株的不断产生,PEDV的入胞过程可能进化出多种机制,而且PEDV可能对包括人类在内的其他物种构成潜在威胁。值得注意的是,PEDV进入宿主细胞的途径可能与所使用的细胞系和环境条件也有一定关联,因此,利用猪肠小体建立的PEDV感染模型有可能会更好的模拟PEDV体内感染的过程[32-33],而如何提高PEDV体外培养对细胞的适应性,进而提高病毒滴度,是研究者们关注和急需解决的重要问题之一。因此,构建不依赖于胰蛋白酶的通用的PEDV细胞系,对于PEDV的分离培养、病毒生物学研究,防御病毒感染至关重要。对于PEDV S蛋白与pAPN受体的深入研究将有助于更好地了解病毒入胞机制。PEDV入胞机制的深入研究,也将为靶向入胞途径的抗病毒药物设计提供靶点,并为PEDV的防控提供了新的思路和方向。
动物医学论文范文 第15篇
题目:兔斯氏艾美耳球虫病研究进展
兔球虫病是由艾美耳属(Eimeria)的多种球虫寄生于兔的肠道或胆管上皮细胞内引起的一种寄生虫病。随着规模化养兔的发展,兔球虫病的危害在近些年逐步显现,对我国养兔业的发展造成很大影响。在目前公认的感染兔的11种艾美耳球虫中,斯氏艾美耳球虫(E.stiedai)致病性较强、危害较大,且是唯一寄生在兔肝胆管上皮细胞内的兔球虫。
1 病原形态特征
斯氏艾美耳球虫卵囊一般为长卵圆形或近似椭圆形,卵囊大小为36.4 μm(31.3 μm~38.7 μm)×22.8 μm(19.1 μm~27.8 μm),卵囊指数为1.59,不同地区分离株大小有一定差异[1]。卵囊一般呈淡黄或橘黄色,在较小一端往往呈削平状或凹陷,卵囊壁非常薄、整体上光滑均厚,成熟卵囊内没有外残体,有些卵囊存在散在颗粒状外残体,但因为孢子囊的遮挡而很难被看到。孢子囊为长卵圆形,一端有斯氏体,内残体明显。子孢子的宽端有一折光体位于核后,呈球形,约占子孢子纵长的1/3~2/5。
2 生活史
斯氏艾美耳球虫是少数几种寄生在肝脏胆管上皮细胞内的球虫之一,它的发育过程可分为裂殖生殖、配子生殖和孢子生殖3个阶段。家兔食入孢子化卵囊后,经过肠道中胆汁和胰酶的作用,子孢子从卵囊中逸出,进入肠固有层淋巴管、肠系膜淋巴结,然后通过乳糜池进入血液循环,随着肝动脉流入胆管周围毛细血管丛并由此处侵入胆管上皮细胞。
子孢子钻入上皮细胞后,很快扩大变成裂殖体,经过多次分裂后形成许多裂殖子。这些裂殖子从死亡的上皮细胞中溢出,继续侵袭新的上皮细胞。在裂殖生殖阶段,Pellerdy L P等曾提出有5代或6代,裂殖体可分为A、B两型或三型。国内一般将裂殖生殖划分为4代,并首次提出肝球虫裂殖生殖具有多态现象,即裂殖体以多态方式产生下代裂殖子,包括子孢子型裂殖体、双核或多核的裂殖子型裂殖体、单核裂殖子型裂殖体和经典型裂殖体。经过多次无性繁殖,裂殖子会分裂发育成两性配子。两性的大小配子发育成熟后,小配子进入大配子结合为合子,合子外面迅速包上被膜后形成卵囊并随粪便排出体外。
刚从粪便中排出的卵囊还未孢子化,不能感染家兔。经过适宜的温度、湿度和氧气浓度的诱导,可发育成为具有感染力的孢子化卵囊。孢子化的完成意味着卵囊已具备感染力,过去曾经认为斯氏体的出现是孢子化完成的标志,但后来通过镜检观察发现,在子孢子发育早期即出现斯氏体,因此将子孢子的可分辨度及折光体的出现作为孢子化完成的标志比较合理。
3 流行病学
各种品种和不同年龄的兔都可感染斯氏艾美耳球虫,但以1月龄~3月龄的兔最易感而且病情严重,死亡率高。该病一年四季均可发生,阴雨季节多发,均呈地方性流行。斯氏艾美耳球虫病在我国分布范围很广,重庆、甘肃、海南、河北、河南、青海、江苏、山东、陕西、浙江、新疆等地均有报道。
4 致病性
患病的家兔通常表现出精神不振,食欲减退,动作迟缓,伏卧不动等症状。继续发展会出现鼻腔、眼部分泌物及唾液分泌增多,并出现贫血、黄疸及腹泻,虚弱消瘦,生长停滞。严重病例有时出现神经症状,站立不稳,四肢麻痹,病程较短,很快死亡[2]。剖检发现感染严重的家兔肝脏高度肿大,肝脏表面及实质内有黄豆大小的沿胆小管分布的白色或淡黄色结节。对结节病灶进行镜检,可以看到各个发育阶段的球虫,肝实质发生局部坏死。胆管增生变大,管壁明显增厚,胆管内充满暗绿色胆汁,镜检可见到大量卵囊及脱落的上皮细胞和炎性细胞浸润。有学者发现感染斯氏艾美耳球虫后丙氨酸转移酶、天冬氨酸转移酶、碱性磷酸酶和γ谷氨酰转肽酶活性升高,总蛋白、球蛋白、总胆红素含量升高[3]。也有学者检测了斯氏艾美耳球虫感染兔的血常规、肝功能和凝血4项等血液指标,肝功能指标与其他学者的结果基本一致,还发现乳酸脱氢酶显著增高,血清胆碱酯酶显著降低[4]。对人工感染斯氏艾美耳球虫后不同时间段血清中丙二醛含量及超氧化物歧化酶活性进行检测,发现感染初期丙二醛含量明显升高,超氧化物歧化酶活性有明显下降,但后期可逐渐恢复至正常水平,表明感染所致的病理氧化应激可通过肝脏代偿维持[5]。
肝球虫的感染造成肝细胞的损伤和坏死,影响肝脏的分解、合成、生物转化及排泄功能,使得机体的代谢功能出现异常,最终导致家兔死亡。在一定的数量范围内,家兔吞食的卵囊数越多,表现出的病理变化越明显[6]。
5 诊断方法
5.1 卵囊漂浮检测
改进的饱和食盐水漂浮法,只取1粒粪便,加饱和食盐水搅拌后过滤进青霉素瓶中,用吸管从液面前后左右中5个方向吸取表面粪液滴加于带凹槽的载玻片上镜检。检测出了包含斯氏艾美耳球虫在内的7种球虫,可节省取样时间,操作简便[7]。
5.2 组织病理学检测
病理变化主要发生在肝脏,肝脏肿大并有结节病灶,镜检可观察到肝脏组织变性坏死,肝胆管上皮增生,可见大量不同发育阶段的虫体[8]。
5.3 血清学检测
Rose M E 采用补体结合试验检测感染斯氏艾美耳球虫病家兔血清中的抗体,最早可在感染后3 d~7 d检测到补体结合滴度的增加。Abu-El-Ezz N M T等[9]采用卵囊计数、组织病理学和ELISA进行诊断,发现使用卵囊抗原检测抗体的ELISA可在感染后1周检测到抗体,是早期诊断肝球虫病的最佳方法。
魏闻芮等[10]建立了一种以斯氏艾美耳球虫MIC-1和MIC-3重组蛋白为抗原诊断肝球虫病的间接ELISA方法,敏感性和特异性都非常高,感染后第6、8、10天均能检测到相应的抗体。
5.4 分子生物学检测
Oliveir U C等[11]建立了一种基于ITS1序列作为靶标分子进行PCR扩增来鉴别诊断11种兔球虫病的方法,种间无交叉反应,敏感性可达0.8个~1.7个孢子化卵囊。
闫文朝等[12-13]成功克隆了斯氏艾美耳球虫完整的 ITS1-5.8S rRNA-ITS2 序列,并以该序列为目的基因,建立了能有效检测出50个斯氏艾美耳球虫卵囊的灵敏性高、特异性强的PCR检测方法。还以此为基础建立了用于区分和鉴定斯氏艾美耳球虫病、肠艾美耳球虫病和黄艾美耳球虫病的多重PCR诊断方法。
汪运舟等[14]建立了基于全基因组扩增技术的兔球虫单卵囊PCR技术,能够在单个卵囊的水平上进行虫种鉴定,从而大大提高PCR反应的灵敏度。
Hassan K M等[15]提取了感染家兔粪便、全血样本、肝组织的DNA,基于ITS1序列设计引物进行PCR检测,发现最早可在感染后12 d从肝组织中检测到PCR阳性。
梁子平等[16]以球虫ITS1基因为种属特异性检测的PCR分子靶标,针对兔源11种艾美耳球虫病建立了多重PCR联检方法,对检测目标表现出了高敏感性和高特异性。该多重PCR联检方法平均最低可检测到大约0.8个~1.7个的孢子化卵囊。
温福利等[17-18]根据E.stiedaiITS1区域的基因保守序列设计引物,建立的实时荧光定量PCR方法特异性强,灵敏度高,可检出含1个卵囊DNA的样本,适用于感染初期的定量检测。还根据E.stiedai的ITS1-5.8sRNA-ITS2 基因序列设计特异引物,建立了环介导等温扩增(LAMP)检测方法,对待检样本进行10倍稀释后,仍能够检测到36 copies/mL的DNA样本,具有特异性和较高的敏感性。
6 免疫学
用免疫组化链霉亲和素-生物素复合物法对斯氏艾美耳球虫感染后家兔体内球虫抗原的分布进行观察,发现肝脏窦状隙、胆管上皮细胞、肝门淋巴结和脾脏内有明显的棕黄色阳性反应区,说明这些区域和部位有相应的E.stiedai抗原存在,且抗原数量最多的是肝脏,其次为脾脏,肝门淋巴结最少[19]。试验证明,斯氏艾美耳球虫感染家兔后可以激发体液免疫应答,产生的特异性抗体能够作用于卵囊抗原和粪便抗原,抗体水平高低能够说明保护性免疫应答水平的高低。
6.1 活疫苗
不同剂量的γ射线辐射可以不同程度地降低斯氏艾美耳球虫的致病性,45 krad的γ射线辐射剂量仍不能使孢子化卵囊致死。虽不能使接种动物发病,但能使动物感染,刺激机体产生相当程度的免疫保护力。
有学者用超声处理的卵囊免疫家兔,发现免疫组的卵囊产出要低于未免疫组,而血清抗体水平则高于未免疫组[20]。
6.2 亚单位疫苗
Hanada S等用从感染兔的胆汁中提取的裂殖体抗原免疫无球虫兔,发现免疫兔的胆管周围聚集较多的炎性细胞,而虫体较少,排卵量也少于未免疫的兔。Omata Y等用感染15 d后胆汁中的子孢子和裂殖体抗原免疫兔后再攻虫,免疫组卵囊排出数量比对照组少。Abdel K N等用粪抗原加弗氏佐剂免疫接种无球虫兔后,经口攻毒孢子化卵囊。结果显示,免疫组排出的卵囊数量减少,体液免疫应答水平也比对照组高,可以提供70%的免疫保护力。
6.3 疫苗候选基因与基因工程苗
有学者成功将微线蛋白和肌动蛋白解聚因子基因进行克隆并在真核细胞中进行了表达,也有学者原核克隆表达了菱形体蛋白、热休克蛋白、天冬氨酸蛋白酶基因并进行了Western blot分析[21-26]。
有研究者构建了微线蛋白与白介素IL-15共表达真核载体,并转入减毒鼠伤寒沙门菌,免疫试验结果表明,该重组菌能诱导机体产生较高水平的抗球虫细胞免疫应答和体液免疫应答,抗球虫指数达到160以上,具有中等抗球虫效力[27]。
7 药物治疗
由于还没有研究出商品化疫苗,目前斯氏艾美耳球虫病的防控主要依靠药物,妥曲珠利、地克珠利、α-二氟甲基鸟氨酸、莫能菌素、盐霉素、马杜拉霉素、拉沙洛菌素等都在临床中有应用。
赵爱云等[28]观察了3种抗球虫药对斯氏艾美耳球虫病的敏感性,结果表明,球虫血痢散(主要成分为磺胺喹噁啉)的增重效果较好,但是不能很好地抑制卵囊排出;球虫血痢清(主要成分为鹤虱、槟榔、雷丸等14种中药)在增重和抑制卵囊排出这两方面效果都比较好;试验虫株已经对兔血痢灵(主要成分为盐酸氯苯胍)产生了一定的耐药性。
Al-Mathal E M[29]观察了橄榄科植物没药(Commiphoramolmol)对兔肝球虫病的治疗效果,发现没药的商业化提取物Mirazid和天然产物都可以降低卵囊排出量,最终达到治愈的效果,但Mirazid更高效。
Baghdadi H B等[30]通过试验证实黑种草(NigellasativaL.)的种子混悬剂和油乳剂是一种安全有效的治疗斯氏艾美耳球虫病的药物。
王玺德等[31]通过试验证明灌服石榴皮水提物后,家兔排出的斯氏艾美耳球虫卵囊的比重显著减少;饲喂盐酸氯苯胍的家兔,排出卵囊的比重也减少。
宋宏晓等[32]对比了癸氧喹酯与妥曲珠利对斯氏艾美尔球虫病的治疗效果,发现在平均增重、卵囊排出量、病变记分方面,两组差异显著,妥曲珠利效果优于癸氧喹酯。
Indrasanti D等[33]发现大蒜提取物对斯氏艾美耳球虫的卵囊形成有一定抑制作用。
兰家花[34]在一份感染斯氏艾美耳球虫家兔的诊治报告中,采用氯苯胍按每千克精料加100 mg混合均匀;磺胺六甲氧嘧啶,按每千克精料加1 g混饲1周并配合饲养管理,用药3 d~5 d后患兔病情开始好转,用药2个疗程后,未见幼兔死亡,疫情得到有效控制。
Eladl A H等[35]使用商业化的植物提取物Herba Cox®治疗人工感染斯氏艾美耳球虫病的家兔,感染前7 d到感染后28 d连续使用,可以减轻临床症状,改善肝脏功能,减少卵囊排出,是一种新型安全高效的治疗方法。
从以上研究可以看出,对于抗斯氏艾美耳球虫病药物的研究,有从传统化学药物转向天然草本药物、从治疗为主转向预防为主的趋势。
8 展望
目前对斯氏艾美耳球虫病的防控仍是以药物防治为主,疫苗研究尚未取得实质性进展,还没有商业化疫苗问世。但是,随着基因组学的发展,更多的疫苗候选基因将被筛选评估,相信不久的将来就可以研制出安全高效的基因工程疫苗,给养兔业带来福音。
相关推荐:动物医学论文题目(点击可查看)
本站论文范文来源网络,若内容不实或侵害了您的合法权益,请及时联系我们进行删除!原文链接: » 动物医学论文(精选15篇)











